Inscription / Connexion Nouveau Sujet
PKA, PH , concentration d'un diacide
bonsoir 
Je fais appel à vous pour un exercice de biochimie ...
Soit un diacide Ah2, possédant deux pka :pka1 = 4,5 et pka2 = 10
On suit le dosage PH-métrique de 20ml dune solution de ce diacide par de la soude.
A pka1 on a versé 8 ml de naOH
A pka2 on a versé 16ml de naoh
Au PH1 de demi équivalence , on a autant d'acide que de base
PHE(1/2) = pKA
A ph=2 , on a atteint le ph de demi équivalence : A cet endroit le PKA = 2 . Le volume de soude versé est égal à la quantité de diacide ayant réagi , c'est à dire à la quantité de diacide restant dans le bécher.
Mais on a deux pka !! Car il y a deux fonctions acide ...
Mais du coup je comprends pas trop ce qu'il se passe concrétement :§ Les deux acides sont les même .. ? :/
Le Ph2 de demi équivalence c'est 7 ( si je ne me trompe pas ? ) A ce stade on a versé 12ml de nAoh ...
Le fait qu'il y ait 2 PKA signifie que les deux fonctions acide COOH ne s'ionisent pas au même PH ?
Mais ça veut dire qu'une fois que j'ai passé le PKA1, la forme basique [OH] domine pour le 1er acide , mais il y a tout de même de l'acide encore présent (le 2ème ! qui s'ionise qu'à PKA2 ... )
dsl c'est confus ...
On me demande de calculer la concentration molaire du diacide sachant que la solution de soude qui a neutralisé le diacide est à 10g.L^-1
M(NaoH) = 40g.mol^-1
la solution de ce soude neutralise les acides complétement après PKA2 ...
je ne vois pas trop là...
je vous met le graphe , en espérant que ce que j'ai indiqué dessus ne soit pas erroné ...
merci beaucoup !
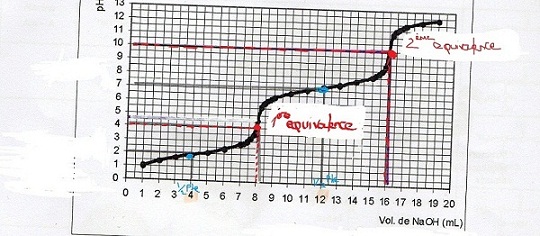
- au vu de ta courbe les pKa du diacide sont 2 et 7 et non 4.5 et 10 comme tu le dis au début .... alors j'ai bien du mal à comprendre !
- lorsqu'on a un diacide faible AH2 et que l'on ajoute de la soude OH- on fait les réactions successives suivantes :
1) AH2 + OH- -> AH- + H2O qui necessite autant de OH- qu'il y avait de AH2 au départ. Lorsque l'on est à la demi-équivalence ( v = mL ) on a dans la solution autant de AH2 que de AH- et pH = pKa ( ici pKa1 = 2 ) . A l'équivalence ( v=8 mL ) tout les AH2 de départ sont devenus AH- .
2) AH- + OH- -> A2- + H2O
A la deuxième demi-équivalence ( v=12 mL) on a pH = PK2 ( ici pK2 = 7 ) et à la dexième demiéquivalence ( v = 16 mL ) on a transformé tous les AH- en A2-
- Si tu as bien compris ce que l'on fait tu ne devrais avoir aucune peine à répondre à la dernière question .
je réponds très tard car je ne me suis plus trop penchée sur le problème une fois que je l'ai fait en cours ...
A la demi équivalence, on a Ph = Pka et on a autant d'acide et de base conjuguée. [AH2] = [AH-]. En effet, à la demi équivalence la moitié de l'acide a réagi.
A l'équivalence , tout le réactif limitant ( ici l'acide ) a réagi.
Pourtant, j'ai l'habitude d'écrire depuis la 1er :
A l'équivalence, nH+ libérés = n diacide AH2
cela veut surement dire qu'à Volume éq la quantité de soude versée est égale à la quantité d'acide consommée ( et donc à la quantité d'acide disparu )
En gros on peut écrire n(AH2 ) = n(AH-) à la demi équivalence ET à l'équivalence ?
merci & Joyeuses fêtes
Lunie


