Inscription / Connexion Nouveau Sujet
Pile de concentation
Bonjour j'ai un petit exo de chimie sur la pile ci-contre.
J'ai fais les premières questions, qui demandent la fem (0,03V) et les réactions qui se produisent aux électrodes (Cu2+ + 2e- = Cu).
Vient cette question: est-ce que la pile est à l'équilibre ? Sinon vers quel situation va t elle évoluer?
Je ne comprend pas trop cette question...
Merci d'avance pour toute aide.
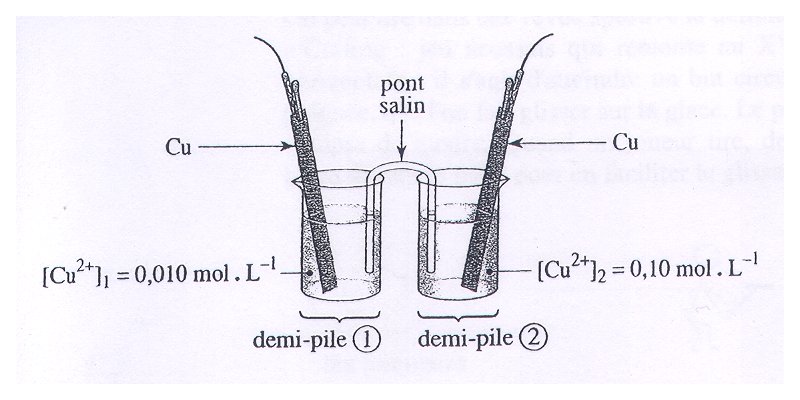
La pile sera en équilibre lorsque les concentrations en Cu2+ seront égales dans les deux compartiments.
puisque ce n'est pas le cas ,elle n'est pas en équilibre
sans présager du sens de la réaction ,on peut écrire
Cu2+(1) +Cu(2) =Cu2+(2) +Cu(1)
le quotient de réaction est
Q=[Cu2+(2)]/[Cu2+(1)]=0,1/0,01 =10
l'équilibre sera atteint lorsque [Cu2+(1)]=[Cu2+(2)]
dans ce cas Q=K=1
telle que l'équation est écrite ,Q >K ,donc la réaction évolue dans le sens indirect (droite gauche).Dans ces conditions,la concentration en Cu2+ va augmenter dans le compartiment 1 et diminuer dans le compartiment 2
Merci pour cette première aide.
Le problème, c'est que dans la question juste après ils demandent de donner l'expresion du quotient de réaction, et de dire sa valeur quand la pile ne débite plus.
Donc en fait tu as répondu à cette question. Mais dans ce cas-là, comment répondre à la question initiale?
Au fait, comment justifies-tu : "La pile sera en équilibre lorsque les concentrations en Cu2+ seront égales dans les deux compartiments." ?
pour la première question ,la pile n'est pas en équilibre car la fem n'est pas nulle.
La pile débite tant qu'une électrode peut fournir des électrons à l'autre par le circuit extérieur.
c'est celle de plus faible concentration qui fournit les e- .Au niveau de cette électrode se produit la réaction Cu=Cu2+ +2e .
la concentration en Cu2+ va augmenter.
Au niveau de l'autre électrode,la réaction inverse se produit
Cu2+ +2e =Cu
la concentration va diminuer.
Lorsqu'il y aura égalité des concentrations ,il n'y aura plus d'oxydation et de réduction au niveau des électrodes puisqu'il n'y aura plus de dissymétrie.Aucune électrode n'aura tendance à céder ou capter des électrons


