Inscription / Connexion Nouveau Sujet
Pile
Voici l'éxo 3 
On désire réaliser une pile avec les couples Ni 2+ / Ni et Al3+ / Al
1. En consultant la classification des potentiels standards donnée dans le cour nommer le couple qui constitue l'anode.
2. Donner la représentation symbolique de la pile
3. Donner l'équation de la réaction à l'anode
4. Donner l'équation de la réaction à la cathode
5. Pourquoi cette réaction est elle irréversible
6. Calculer la force électromotrice de cette pile.
1. Déjà dans notre tableau Ni 2+ / Ni = - 0.25 V
et Al3+ / Al = - 1.67 V
mais du coup ils sont tt les deux négatif donc je sais pas le quel constitue l'anode
Question 1 :
ce n'est pas un problème que les deux soient négatifs, puisqu'on en a un au-dessus de l'autre.
Vu que E(Ni2+/Ni) > E(Al3+/Al), la réaction spontanée serait en toute logique entre Ni2+ et Al.
Bon, on recommence :
* Les couples en jeu sont Ni2+/Ni et Al3+/Al
* Tu as relevé sur le tableau les valeurs des potentiels de ces deux couples :
E2 = E(Ni2+/Ni)= - 0,25 eV
E1 = E(Al3+/Al) = - 1,67 eV
donc on a E2 > E1 donc l'oxydant du couple qui réagit est Ni2+.
Le réducteur du couple qui réagit est Al.
* Les demi-équations sont donc alors :
( Ni2+ + 2e- --> Ni ) x3
( Al --> Al3+ + 3e- ) x2
_______________________________________
3Ni2+ + 2Al --> 3Ni + 2Al3+ est l'équation globale spontanée pour la pile.
* Par définition,
Ni2+ subit un gain d'e- donc une réduction à la cathode
Al subit une perte d'e- donc une oxydation à l'anode.
Tu peux me tutoyer tu sais  .
.
Tant mieux, c'est le but recherché, d'autant que c'est marrant la chimie 
pas de soucis 
Moi de mon coté je trouve ça assez dur depuis que je suis au CNED mais avant j'avais toujours des bonne notes quand j'étais scolarisé dans une école.
Tu t'appel comment si c'est pas indiscret ? ^^ 
En même, il me semble que le niveau du CNED est un peu plus dur que le niveau national ... Cela pourrait expliquer cette sensation de difficulté.
Et c'est Guillaume 
enchanter 
Oui c'est sur , ce qui est le plus dur je dirais c'est de recevoir pour la première fois un gros colis pleins de fascicule et de pas trop savoir quoi en faire et d'êtres démotiver par la quantité de bouquins en école on apprend petit à petit on a + d'explication
je me sens surtout dépasser par toute ces matières , demain j'ai un stage de 4 semaines je sais pas comment je vais concilier les deux
Ce sera dur, mais c'est jouable un peu après les cours.
Tant que le moral est bon, ça devrait le faire  .
.
Mais effectivement, le rythme va être soutenu.
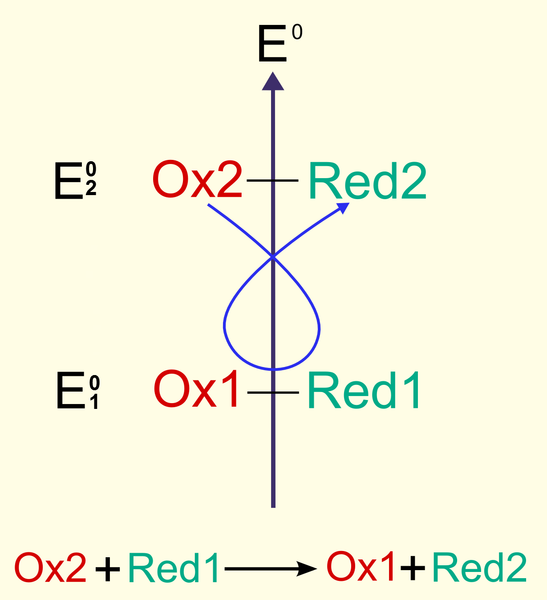
Pour la force électromotrice, en première approximation on peut écrire :
E = E2 - E1 = -0,25 - (-1,67)= .... V
L'évolution spontanée est caractéristique d'une pile.
La transformation inverse est irréversible. Elle n'est possible qu'au moyen d'un électrolyseur, c'est-à-dire en présence d'une source de tension.
On dit que cette transformation est alors forcée.
c'est la réponse de quel questions ça ?
et pour la 3 et 4 je me souviens de comment on fait mais je suis pas sur du quel couple est pour l'anode et le quel pour la cathode
C'était pour la question 5.
La question 6., c'était la force électromotrice.
Concernant les 3. et 4., j'y ai répondu déjà
* Les couples en jeu sont Ni2+/Ni et Al3+/Al
* Tu as relevé sur le tableau les valeurs des potentiels de ces deux couples :
E2 = E(Ni2+/Ni)= - 0,25 eV
E1 = E(Al3+/Al) = - 1,67 eV
donc on a E2 > E1 donc l'oxydant du couple qui réagit est Ni2+.
Le réducteur du couple qui réagit est Al.
* Les demi-équations sont donc alors :
( Ni2+ + 2e- --> Ni ) x3
( Al --> Al3+ + 3e- ) x2
_______________________________________
3Ni2+ + 2Al --> 3Ni + 2Al3+ est l'équation globale spontanée pour la pile.
* Par définition,
Ni2+ subit un gain d'e- donc une réduction à la cathode
Al subit une perte d'e- donc une oxydation à l'anode.

Et non !
Par exemple, dans le cas de la pile Daniell, le schéma conventionnel est le suivant :
(-) Zn|Zn2+ || Cu2+|Cu (+)
Donc ?
Bah, tu as tous les éléments.
Tu sais quels sont les couples en jeu au niveau de l'anode et de la cathode.
Il suffit de savoir qui est la borne + et la borne - de la pile et le tour est joué.
On revient à ton exo mnt, c'était pour te donner un exemple.
Ni2+ subit un gain d'e- donc une réduction à la cathode => c'est le pole + de la pile
Al subit une perte d'e- donc une oxydation à l'anode => c'est le pole -
d'où finalement
(-) Al3+|Al || Ni2+|Ni (+)
donc (-) Al3+|Al || Ni2+|Ni (+) est la réponse de la question 2 ?
ça reste un peu compliqué je pourrais pas faire ça tout les jours
Oui c'est ça, mais ça me paraît hors-programme pour la première ...
Sauf si les programme ont changé mais on ne faisait pas ça à mon époque (et elle n'est pas si lointaine  )
)
et oui comme tu dis tu verrais le niveau demander en math à s'en donner des cheveux blanc.
Surtout que je suis en première pro et non général donc le niveau est SENSER êtres plus simple
Au moins, tu peux te dire que tu as la chance d'avoir une formation de haute qualité au CNED  .
.
On faisait ça en terminale il y a 5 ans ...
Tu as une fiche sur les piles si tu le souhaites en sections terminale pour ta culture d'ailleurs.
Rassemble toutes les données qu'on a vu ensemble pour cet exo, et revois-ça à tête reposée.
Je te souhaite une bonne soirée.

Encore merci pour ton aide.
Dommage j'aurais aimer avoir finit mon devoir avant de commencer mon stage demain