Inscription / Connexion Nouveau Sujet
Oxydation de l'aluminium
Des morceaux d'aluminium sont décapés, puis pesés : leur masse est m₀=0.16g. ils sont ensuite immergés dans un volume V =150mL d'une solution de sulfate de cuivre(II), Cu²⁺(aq)+So²₄⁻(aq), de concentration C₀=0.10mol.L⁻¹.
1. Etablir l'équation de la réaction.
2. Quelles sont les concentrations finales des espèces présentes dans la solution ?
Données : Ox / réd : Cu²⁺(aq)/Cu(s) ; Al³⁺(aq) / Al(s)
Pour écrire l'équation de la réaction, est-ce que je dois écrire les demi équation de Cu²⁺(aq)/Cu(s) ; Al³⁺(aq) / Al(s) ?
Bonjour,
Oui c'est ça, tu écris les deux demi équations, tu les sommes et tu auras l'équation bilan.
Pour les concentrations, fais un tableau d'avancement.
Thetys. 
Merci 
Je trouve:
Cu²⁺(aq)/Cu(s) : Cu²⁺ + 2e- = Cu
Al³⁺(aq) / Al(s) : Al³⁺ + 3e- = Al
Donc:
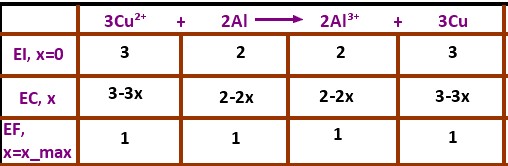
3Cu²⁺ + 2Al  2Al³⁺ + 3Cu
2Al³⁺ + 3Cu
Oui, c'est ça (en n'oubliant pas l'état physique - aqueux, solide dans l'équation bian) 
Et la question b, y arrive tu?
Oui c'est vrai, je les ai oublié 
Oui mais je suis juste embêter pour le tableau d'avancement car pour l'état initial, je dois prendre quel coefficient? ceux des couples Cu²⁺(aq)/Cu(s) Al³⁺(aq) / Al(s) donc 1 ?
Le tableau d'avancement, il faut toujours le faire avec l'équation bilan.
Tu utilises donc les coefficients de l'équation bilan, c'est à dire 2 pour l'aluminium et 3 pour le cuivre
ah désolée, je crois que j'avais mal compris la question...
Non, dans l'état initial, tu dois mettre quelles sont les quantités de matière de chaque réactif ( à calculer) et des produits (nulle, il n'y en a pas)
Pour calculer les quantité de matière, il faut que tu utilises les données de l'énoncé (masse, volume, concentration)
Aouch 
Je crois qu'il faut revoir les tableaux d'avancement.
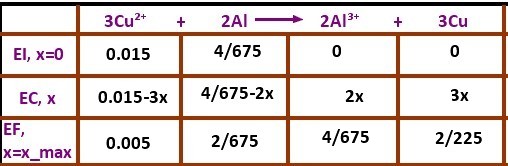
Pour les quantités initiales, c'est ça, même si je ne vois pas d'où sort le 4/ 675. D'ailleurs, quitte à mettre des valeurs numériques dans le tableau, autant mettre des valeurs approchées, pour mieux pouvoir comparer les différentes quantités de matière.
Par contre, pour les produits, fais tattention, c'est 0 + 2x et 0+3x , car les produits se forment.
De plus, comment connais tu xmax? il faut que tu détermines le réactif limitant pour trouver xmax, et de là tu peux en déduire les quantités de matières à l'état final.
T'en sors tu?
entre parenthèse : voir une quantité de matière négative, il faut que ça te choque et que tu fasse un bond de ta chaise si tu rencontres un truc pareil 
(c'est comme avoir -2 crayons, j'ai jamais réussi^^ )
Le 4/675 je les trouvé en calculant la quantité de matière de Al donc m/M(Al) = 0.16/27.0=4/675 0.006.
0.006.
xmax je les calculé:
Si Cu²⁺ est le réactif limitant:
0.015-3x=0
x=0.005
Si Al est le réactif limitant:
4/675-2x=0
x=2/675 0.003
0.003
Donc Al est le réactif limitant.
J'avais fait les calculs sur ma feuille
ok pour la quantité de Cu2+, sauf qu'en physique on se moque pas mal des valeurs exactes, il vaut mieux dire que 0.16/27.0 = 5,9.10-3 (avec deux chiffres significatifs)
ok pour les calculs (il n'y a quand même pas assez de chiffres significatifs, tu dois en avoir 2 normalement)
Cependant, ton tableau n'est pas cohérent avec tes calculs: si Al est le réactif limitant, alors sa quantité de matière à la fin est nulle.
Presque 
Tu as juste trop arrondi à un moment: quand tu enchaînes plusieurs calculs, pense à reprendre la valeur exacte (là pour le coup c'est important, pas à la fin mais pour les calculs intermédiaires sinon tu fais des erreurs d'arrondi)
à l'état final, on doit trouver:
6,1.10-3 0 5,9.10-3 8,9.10-3
Mais ce n'est pas très grave, je ne pense pas qu'on t'enlèverai des points pour ça 
Il ne reste plus qu'à calculer les concentrations!
Je pense qu'il faut calculer la concentration des ions présents à la fin dans la solution, soit Cu2+ et Al3+.
En effet, calculer la concentration d'un solide, ça n'a pas vraiment de sens...
Je t'avoue que je ne suis pas totalement sure de moi sur ce coup là...
dans le doute tu peux calculer celle de Cu si tu n'es pas sure