Inscription / Connexion Nouveau Sujet
oxydation d'un alcool primaire
Bonjour, dans l'exemple de l'oxydation du butan-1-ol par le permanganate de potassium. Comment reconnaitre le butan-1-ol dans le couple CH3CH2CH2CHO/CH3CH2CH2CH2OH, et comment savoir quelle est l'autre espèce du couple?
Merci 
Bonjour,
Je ne comprends pas bien la question.
Dans le couple que tu as indiqué, l'alcool est à droite (on reconnaît le groupe hydroxyle -OH). De plus, tu parles d'oxyder cet alcool, c'est donc qu'il s'agit d'un réducteur (donc situé à droite dans un couple ox/red...).
Enfin, tu devrais savoir (cf : cours de chimie orga) qu'un alcool primaire s'oxyde en aldéhyde puis en acide carboxylique, qu'un alcool secondaire s'oxyde en cétone et qu'un alcool tertiaire ne s'oxyde pas.
Donc, ici, quelle est la classe de l'alcool ? À quelle famille appartient donc l'oxydant de ce couple ?
P.S. : Tu peux aussi représenter ces molécules avec leur formule topologique ou semi-développée et voir si tu reconnais RCOOH (acide carboxylique), RCOR' (cétone), RCOH (aldéhyde)...
Le butan-1-ol est un alcool primaire.
Donc quand la formule brute finie par OH (toujours à la fin?) c'est un alcool.
Un alcool primaire s'oxyde en aldéhyde puis en acide carboxylique, donc CH3CH2CH2CHO est un aldéhyde, mais pourquoi a t il un CH2 en moins? Comment trouver à partir de CH3CH2CH2CH2OH l'espèce conjuguée?
merci masterrr 
Donc quand la formule brute finie par OH (toujours à la fin?) c'est un alcool.
Non : il existe des isomères de position ! C'est bien pour ça qu'on précise qu'il s'agit du butan-1-ol. Il y a aussi le butan-2-ol, etc. Le groupe -OH est fixé sur le carbone 1, 2, etc.
Un alcool primaire s'oxyde en aldéhyde puis en acide carboxylique, donc CH3CH2CH2CHO est un aldéhyde
En effet.
mais pourquoi a t il un CH2 en moins?
Il n'y a pas de CH2 en moins ! Il n'y a aucune raisonne qu'un carbone disparaisse. Par contre, il y a 2 hydrogènes en moins.
Comment trouver à partir de CH3CH2CH2CH2OH l'espèce conjuguée?
Il suffit d'écrire les formules semi-développées. Comment passer de CH3-CH2-CH2-CH2-OH à CH3-CH2-CH2-CH=O ?
On ajoute une double liaison C=O pour obtenir un aldéhyde, on perd donc le H du groupe -OH et comme on a une double liaison et qu'un carbone est tétravalent, il faut également enlever un autre H.
Je crois comprendre.
"Un alcool primaire s'oxyde en aldéhyde puis en acide carboxylique"
Les acides carboxylique comportent le groupement -COOH.
On part donc de CH3-CH2-CH2-CH=O pour trouver l'oxydant qui correspond mais c'est le même problème, je n'arrive pas à la déduire 
Ce n'est pas bien difficile : il faut une double liaison C=O (elle y est déjà) et une liaison C-OH. Il faut donc rajouter -OH sur le même carbone qui comporte la double liaison C=O. Or un carbone est tétravalent, il faut donc enlever un H sur ce carbone afin de satisfaire la règle de l'octet.
"Ce n'est pas bien difficile : il faut une double liaison C=O (elle y est déjà) et une liaison C-OH"
Pourquoi encore une double liaison? Pourquoi C-OH au lieu de -COOH?
Ce qu'on est en train de faire est bien chercher l'oxydant qui va avec le réducteur CH3-CH2-CH2-CH=O et on sait qu'il aura le groupement -COOH non?
Je n'ai jamais parlé d'une AUTRE double liaison C=O. J'ai dit qu'il en fallait une et qu'elle y était déjà (cf : ma parenthèse).
Un groupe -COOH c'est quoi ? C'est un carbone relié à un oxygène par une liaison double (C=O) d'autre part, et à un groupe hydroxyle -OH d'autre part.
Et je t'ai fait remarqué que l'on avait déjà C=O et qu'il ne manquait donc plus qu'à rajouter -OH pour obtenir le groupe -OH, donc l'acide carboxylique !
CH3-CH2-CH2-COOH quoi...
L'acide butan-1-ol s'oxyde en butanal puis en acide butanoïque...
-COOH est la même chose que C=O?
Quoi ?! Comment est-ce qu'un groupe avec un carbone, deux oxygènes et un hydrogène pourrait être identique à un groupe avec un carbone et un oxygène ?
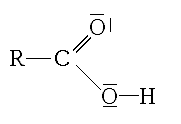
Je dis simplement que -COOH c'est C=O et -OH (voir image jointe).
Un aldéhyde possède a déjà C=O, il ne manque plus que -OH pour passer à un acide carboxylique.
Je ne vois pas où est le problème...
J'ai du mal à trouver l'espèce qui manque dans ce genre de couple oui.
Si on reprend l'oxydation de l'alcool primaire en aldéhyde, comment équilibrer:
CH3CH2CH2CH2OH = CH3CH2CH2CHO +H2O mais du coup on a un O de plus à droite !
Aïe, aïe, aïe...
De quel type de réaction s'agit-t-il ?
Quels sont les couples mis en jeu ?
Quelles sont les demi-équations correspondantes ?
Quelle est donc l'équation de la réaction ?
l'oxydation du butan-1-ol par le permanganate de potassium
c'est une réaction d'oxydo-réduction mais je ne sais comment le justifier...
couples MnO4-/Mn2+ et CH3CH3CH2CHO/CH3CH2CH2CH2OH
MnO4- +2H+ = Mn2+ +H2O +e-
CH3CH2CH2CH2OH = CH3CH2CH2CHO +H2O 
c'est une réaction d'oxydo-réduction mais je ne sais comment le justifier...
En disant, tout simplement, qu'un oxydant (les ions permanganate) est en contact d'un réducteur (le butan-1-ol).
couples MnO4-/Mn2+ et CH3CH3CH2CHO/CH3CH2CH2CH2OH
Oui.
MnO4- +2H+ = Mn2+ +H2O +e-
Beurk ! Premièrement, les électrons sont toujours du côté de l'oxydant. Et deuxièmement, la demi-équation n'est pas équilibrée : compte les oxygènes...
CH3CH2CH2CH2OH = CH3CH2CH2CHO +H2O
Il y a quelques mois tu demandais comment équilibrer une demi-équation d'oxydo-réduction et tu y arrivais. Et maintenant tu ne sais plus faire ? On équilibre les oxygènes avec des molécules d'eau, les hydrogènes avec des ions hydronium et les charges avec des électrons.
Ici, pourquoi ajoute-tu de l'eau ? Les atomes d'oxygène étaient déjà équilibrés ! Ajuste les atomes d'hydrogène avec des ions hydronium, puis les charges avec des électrons.
mince
MnO4- +4H+ +2e- = Mn2+ + 2H20
Je dois toujours reprendre dès le départ tous mes cours.... je perds tout si je ne réactive pas régulièrement.
CH3CH2CH2CH2OH = CH3CH2CH2CHO +H+ +e-
MnO4- +4H+ +2e- = Mn2+ + 2H20
Non : ce n'est toujours pas ça...
Combien y a-t-il d'oxygène à gauche ? à droite ? Conclusion ?
Je dois toujours reprendre dès le départ tous mes cours.... je perds tout si je ne réactive pas régulièrement.
Dans ce cas là, c'est que ta méthode de travail doit être remise en cause. Apprends-tu par cœur ? Auquel cas, c'est normal que tu oublies. Il faut préférer la compréhension à l'apprentissage par cœur. Quand on comprend quelque chose, on est capable de le retrouver ; alors qu'avec l'apprentissage par cœur, on oublie à force. Ce qui n'exclut pas quelque piqûres de rappels de temps en temps

CH3CH2CH2CH2OH = CH3CH2CH2CHO +H+ +e-
Non plus... Combien d'hydrogène à gauche ? à droite ? Conclusion ?
Je n'apprends pas par coeur malheureusement, je ne fais que comprendre au lieu d'apprendre et même ce que je comprends je l'oublie au fur et à mesure..
Alors :
MnO4- + 8H+ + 5e- = Mn2+ + 4H20 X2
CH3CH2CH2CH2OH = CH3CH2CH2CHO +2H+ +2e- X5
2MnO4- + 16H+ +5 CH3CH2CH2CH2OH  2Mn2+ + 8H2O + 10H+ + 5 CH3CH2CH2CHO
2Mn2+ + 8H2O + 10H+ + 5 CH3CH2CH2CHO
soit
2MnO4- + 6H+ +5 CH3CH2CH2CH2OH  2Mn2+ + 8H2O ++ 5 CH3CH2CH2CHO
2Mn2+ + 8H2O ++ 5 CH3CH2CH2CHO
yes? 
Je n'apprends pas par coeur malheureusement
Pourquoi malheureusement ? Au contraire, il faut préférer, de loin, la compréhension à l'apprentissage par cœur.
yes?

I agree.
Malheureusement car même en ayant théoriquement une même méthode, ça ne marche pas.
J'ouvre un autre topic si tu as le temps 
Merci beaucoup de m'avoir aidée à remettre en route tout ça.



