Inscription / Connexion Nouveau Sujet
Oxydation
J'ai un tableau avec le volume de thiosulfate versé pour atteindre l'équivalence, à différentes dates :
t (en secondes) V(
____60___________________5.8
___180___________________7.2
___270___________________12.8 Le tableau est plus long mais suffit de m'expliquer avec les premiers, je ferai la suite.
___360___________________13.2
Ensuite on me donne les couples de la réaction entre l'eau oxygénée en milieu acide avec les ions iodure :
donc l'équation bilan est :
Ensuite les couples de la réaction entre le diiode et le thiosulfate de sodium :
Eaquation bilan :
Exprimer le nombre de mol
J'espère que c'est assez clair...
A partir de là, je dois faire un tableau d'avancement pour trouver le nombre de mol suivant l'avancement x à chaque date ? Et je dois faire ce tableau avec la deuxième équation bilan non ?
merci pour votre aide...
Salut !
!
Commence par établir un tableau d'avancement de la réaction de dosage.
Tu dois avoir comme relation à l'équivalence: n(S2O32-) - 2xmax = 0 et n(I2) - xmax= 0
Cette relation permet de déterminer la quantité de matière de diiode présente dans le volume V0 à partir de la quantité de matière d'ions thiosulfate versé.
On peut écrire : nversée(S2O32-) = 2nt(I2).
L'expression nt(I2) représente la quantité de matière de diiode présente dans le volume V0.
À l'équivalence: 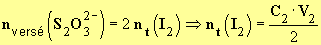
oncentration en diiode dans le mélange réactionnel à la date t: 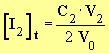
La concentration en diiode dans le mélange réactionnel est la même que celle dans le volume V0.
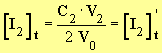
Quantité de matière de diiode dans le mélange réactionnel:
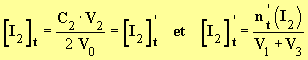
Sachant que : n't(I2) = x(t), tu peux en déduire la relation donnant l'avancement temporel x(t) de la réaction...
Ok?
Bonjour Shadowmiko...
Merci pour toutes tes réponses.
On me demande le nombre de mol de , je ne comprend pas vraiment le raisonnement... Je ne vois pas à quoi correspond chaque expression et qu'elle en est son utilité. :s
=
=> nombre de mol de
à la date t... Mais je comprend pas le "truc" de volume prélevée et volume de thiosulfate versée. Il faut signifier à chaque fois leur valeur ?
De meme, je ne comprend pas ton deuxième poste, à quoi sert de calculer toute les conectration en ?
Je suis désolé :s Merci de ton aide
On te demande le nb de moles de I2 en fonction de Véq non?
Mon deuxième post te sert pour la concentration en fonction du temps...
Humf. Exacte... Désolé !
C'est bon, je pense avoir tout compris. Merci pour ta grande aide Shadowmiko... 
Passe une bonne soirée




