Inscription / Connexion Nouveau Sujet
Molécules a liaisons multiples
Salut!
Il se trouve que j'ai un dm a rendre pour demain.
Le problème c'est que je l'ai fait avec mon prof mais que je ne retrouve pas les mêmes réponses, je ne comprends vraiment pas sa logique !
aidez moi 
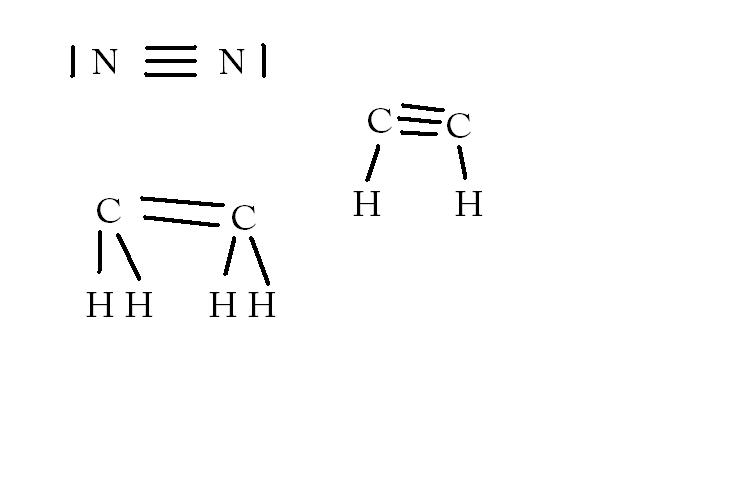
consignes: donner les formules de Lewis des molécules de formules brutes suivantes: diazote N2
éthène C2H4
éthyne C2H2
phosgène COCL2
méthanal CH2O
pour le premier je trouve sa : 2 doublets non liants N 1 doublet liant N 2 doublets non liants
mon profs trouve 3 doublets non liants N un doublet liant N 3 doublets non liants
Bonjour en fait le système est simple donc :
z(azote)=7
(k)2 (L) 5 sous couches : ° ° ° ° ° >>>> 1 doublet non liant et 3 doublets liants
Donc je t'ai fait un dessin et aussi pour l'éthene et l'ethyne après tu peux trouver tout seul
Bonjour,
Applique la méthode suivante pour toutes les représentation de Lewis (je te la montre avec l'éxempledu Triméthylamine )
Formule brute :
On fait atome par atome.
°C:Z=6
1)Tu établie premiérement sa structure électronique à partir se son numéro atomique :
2) (C)(nombres d'électrons sur la couche externe de l'atome de carbone) = 4 (puisque
)
3)Tu établies le nombres de liaison covalente, c'est a dire le nombre de liaison que devras établir cette atome de facon a obtenir une structure électronique stable, en octer ou en duet. Comme son numéro atomique est il respect la règne de l'octet. Donc
(nombre liaison covalente) = 8-4=4 (tu fais la régle qu'il respect - son nombre sur couche externe)
4)Ensuite tu établie le nombre de doublet non-liants avec la formule Tu divise par deux comme ces des doublets.Pour le carbone c'est 0, pour l'Hydrogène 0 et l'azote a 1 doublet non liants (jte fais pas le calcul, si tu le fait je te corrigerais)
5) tu fait pareille avec les 3 atomes qui compose cette molécule.
6) Tu calcul combien il y a de liaison pour tout la molécule (le nombre total)
Fait les calcul et la représentation, je te corrigerais, j'ai eu 20 ; 20 et 18.5 a mes controle la dessus.
J'adore les molécules 
Quand on a tout compris on se dit que c'est vraiment simple
aller je te fais le dernier :
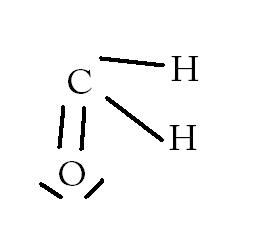
méthanal CH2O
comme l'a dit Gros-Beta on fait atome par atone donc :
l'atome de carbone : C (K)2 (L)4 4 doublet liants
l'atome d'hydrogène : (K)1 1 doublet liant
l'atome d'oxygène : (K)2 (L)6 donc 2 doublets liants et 2 non liants
Sur ma representation on a bien chaques doublets