Inscription / Connexion Nouveau Sujet
Molécule plane
Bonjour,
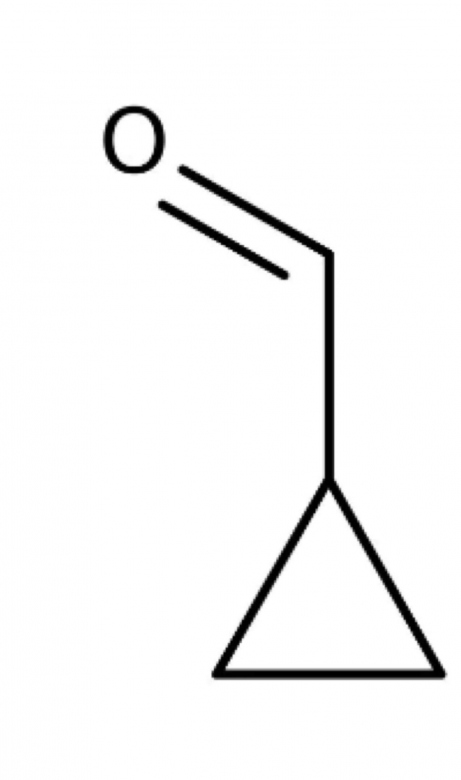
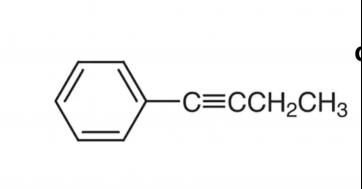
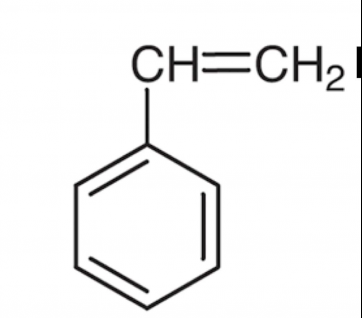
Comment savoir quelle molécule est plane entre ces 3 molécules ?
Merci
Bonjour
Tu dois savoir que la présence d'une liaison  impose aux quatre liaisons
impose aux quatre liaisons  concernant les deux atomes C liés par la liaison
concernant les deux atomes C liés par la liaison  d'appartenir à un même plan. La présence d'un carbone lié par quatre liaisons
d'appartenir à un même plan. La présence d'un carbone lié par quatre liaisons  conduit à une structure de type tétraédrique (éventuellement déformé) donc non plane.
conduit à une structure de type tétraédrique (éventuellement déformé) donc non plane.
Je te laisse réfléchir...
Oui. Il y a bien le problème de la liaison  entre le groupement phényle et le reste de la molécule qui permet la libre rotation du groupement phényle autour de l'axe de cette liaison, ce qui permet théoriquement une infinité de conformations qui ne sont pas planes. En pratique, les interactions à distance entre les électrons
entre le groupement phényle et le reste de la molécule qui permet la libre rotation du groupement phényle autour de l'axe de cette liaison, ce qui permet théoriquement une infinité de conformations qui ne sont pas planes. En pratique, les interactions à distance entre les électrons  du groupement phényle et les électrons
du groupement phényle et les électrons  du radical vinyle font que la conformation plane de la molécule est la plus stable.
du radical vinyle font que la conformation plane de la molécule est la plus stable.
Quand deux groupes d'atomes sont reliés par une simple liaison (type  ) un groupe d'atome est susceptible de tourner par rapport à l'autre autour de l'axe de cette liaison
) un groupe d'atome est susceptible de tourner par rapport à l'autre autour de l'axe de cette liaison  alors qu'une double liaison interdit cette libre rotation.
alors qu'une double liaison interdit cette libre rotation.