Inscription / Connexion Nouveau Sujet
mise en solution d'un gaz
bonjour voila j'ai un DM à rendre pour jeudi et je planche sur l'exo 3
voici l'énoncé:
La molécule de chlorure d'hydrogène est une molécule polaire. Sa mise en solution dans l'eau permet d'obtenir une solution aqueuse d'acide chloridrique.
1. Expliquer la polarité de la molécule.
2. Qu'appelle t-on phénomène de solvatation des ions en solution aqueuse?
quelqu'un pourrait m'aider svp? Merci d'avance!
Salut !
!
1) Tu as [img1].
le chlore est plus électronégatif que l'hydrogène. Le doublet qui assure la liaison entre ces deux atomes se déplace vers le chlore.
Il apparaît donc, au voisinage de l'hydrogène, une densité électrique positive (notée  +) qui correspond à un déficit électronique sur cet atome.
+) qui correspond à un déficit électronique sur cet atome.
Il apparaît de même, au voisinage du chlore, une densité électrique négative (notée  -) qui correspond à un excès électronique sur cet atome.
-) qui correspond à un excès électronique sur cet atome.
Il apparaît donc deux pôles électriques différents et distincts aux extrémités de la liaison H—Cl. On dit que cette liaison est polarisée. Il en résulte que la molécule HCl présente un caractère polaire.
2) C'est du cours...
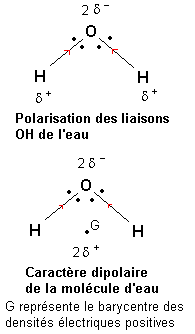
L'électronégativité de l'oxygène est plus forte que celle de l'hydrogène. Une étude du déplacement des doublets de liaison semblable à celle conduite dans le paragraphe précédent montre que les liaisons O—H de la molécule d'eau sont polarisées de telle façon que l'oxygène porte une densité électrique négative (2 -) et que chaque hydrogène porte une densité électrique positive (
-) et que chaque hydrogène porte une densité électrique positive ( +).
+).
Le barycentre des densités électriques positives se situe au milieu du segment joignant les deux atomes d'hydrogène (voir figure). Il apparaît alors qu'étant donnée la forme de la molécule d'eau, les barycentres des densités électriques positives et négatives sont distincts. La molécule d'eau présente un caractère polaire (on dit dipolaire si il y a deux pôles).
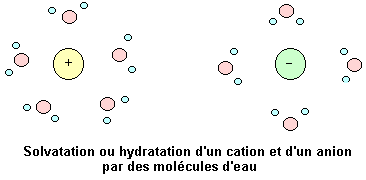
L'eau a pour propriété de détruire les solides ioniques et de disperser les ions. Ces phénomènes s'accompagnent du phénomène de solvatation des ions. Cette solvatation est due au caractère dipolaire de l'eau.
Les cations en solution attirent (interaction électrique) les molécules d'eau par leur partie négative. Il en résulte que chaque cation s'entoure d'un certain nombre de molécules d'eau.
Les anions en solution attirent les molécules d'eau par leur partie positive. Il en résulte que chaque anion s'entoure d'un certain nombre de molécules d'eau.
Ce phénomène est appelé solvatation des ions. Lorsque le solvant est l'eau, la solvatation est appelée hydratation.
merci beaucoup j'avais mis a peu près pareil pour la deux mais j'étais pas sur donc j'ai préferer demander