Inscription / Connexion Nouveau Sujet
Lewis/Cram
Bonjour ,
En fait, je n'arrive pas à représenter une molécule en CRAM en partant de Lewis ?! :s Je ne sais jamais quelle molécule doit être devant , derrière ou dans le plan ?!
Merci de m'aider s'il vous plait!
Bonne journée à tous.
Non pas de molécule en particulier c'est surtout de manière générale que je veux apprendre à passer du Lewis au Cram pour que ça me facilite le passage au Fisher puis au Newman.
Mais si vous avez un exemple pour m'expliquer ça me va , je vous en remercie 
Bon déjà c'est une représentation qui te permet entre autres de visualiser les carbones asymétriques et de déterminer si une molécule est chirale.
Le cheminement c'est tout d'abord d'essayer de faire une représentation de Lewis. Ça je suppose que tu maîtrises vu ton message.
Ensuite il faut que tu regardes si cette molécule est plane ou non. Si non, pourquoi ? (groupements particuliers, configuration, etc.)
Pour Cram il faut que tu repères les C*. Et en regardant Lewis tu essaies de te représenter la perspective de la molécule.
Je ne vois pas d'autres procédures à suivre. Le truc c'est d'essayer de visualiser la molécule dans l'espace. Généralement que tu places d'abord une molécule en avant ou en arrière ne gène pas puisque tu peux obtenir des isomères. Ce qui peut t'aider à représenter, c'est quand on te donne une configuration particulière à respecter : tel groupement qui doit être R ou S. Dans ce cas tu sais quel est l'isomère que tu dois dessiner puisque tu sais dans quel sens "tourner".
Quand vous dites molécule plane vous insinuez linéaire?
C'est aussi pour cela que je me pose des questions, parce que que ça tourne en S ou R parfois cela dépend de la position de l'hydrogène alors comment savoir s'il faut le placer dans le plan ou pas?
Voilà l'exemple de l'éthanol dont la formule de Lewis est la suivante :
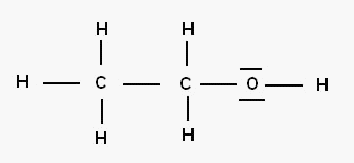
Et bien là je ne sais pas quoi mettre dans le plan, devant et derrière?!
Merci!
Edit Coll : image placée sur le serveur de l'  Merci d'en faire autant la prochaine fois !
Merci d'en faire autant la prochaine fois ! 
![]()
oui à ta première question.
Bien déjà quel est ton carbone asymétrique ? Ensuite quel groupement placerais-tu en haut ? Derrière ? Devant ?
Ce que tu dois bien respecter ici c'est "l'alignement" entre CH3 et OH.
Et bien je dirais que le carbone asymétrique c'est le 2ème car il a 4 liaisons avec une fonction OH.
Donc après justement je ne sais pas quelles règles je dois appliquer pour savoir quel groupement placer à quel endroit ?! si mon OH sera sur le plan, devant ou derrière et pareil pour le CH3 et les 2 H ?!
4 liaisons oui mais sont-elles différentes ? A t-on besoin d'un C* pour faire une représentation de Cram ?
Et bien je ne crois pas parce que pour moi le C* c'est plus pour du Fisher :s
Après je suis désolée mais je ne vois pas du tout comment faire :s c'est justement ça je pense je ne connais pas les règles et j'ai beaucoup de mal à visualiser en 3D :s
Tu as un C* quand tu est lié à quatre groupements différents. Ici tu es lié deux fois à un C pour l'un et trois fois pour l'autre. Mais tu n'es pas obligé d'avoir un C* pour faire du Cram.
Le but de Cram c'est d'éclater la molécule en "3D" pour mieux la visualiser. Donc ici le plus simple pour visualiser toute la structure c'est de laisser la liaison C-C fixe et d'éclater autour des carbones. Après là peu importe la position du groupement car tu peux tourner autour de la liaison (on ne t'a pas imposé de configuration particulière)
D'accord mais dans ce cas là quand on dit que " ça tourne en S mais c'est un R car l'hydrogène est placé derrière" comment cela s'explique?!
arf. En fait tu vas trouver que ça tourne en R selon les règles CIP. Mais tu ne tournes réellement pas dans le même sens quand le groupement prioritaire est placé en arrière. Pour le coup je conteste pas que tu as malheureusement un pb de visualisation dans l'espace parce-que ce n'est pas un pb de méthode.
Pour ça tu considères un centre stéréogène qui peut être un carbone asymétrique. Après tu peux voir ça comme deux groupement dans un plan et celui placé derrière n'est pas dedans



