Inscription / Connexion Nouveau Sujet
les charges dans une demi équation électronique
Bonjour,
dans une demi équation, on a rajouté 7 H(2)O dans les produits, donc on a équilibré par 14 H+ dans les réactifs.
Pourquoi on a utilisé des ions hydrogènes et pas de l'hydrogène stable? Du coup après, on a rajouté 6 électrons pour compenser les charges positives avec +6e-.
C'est pour le couple CR(2) O(2)7 en réactif et Cr3+ en produit. (je trouve pas l'écriture scientifique sur le LTX?)
Merci
***Niveau mis en accord avec le profil***
Bonjour
La demi équation doit faire intervenir des réactifs présents lors de l'expérience pour que l'étude théorique soit réaliste. Or, ici, le milieu réactionnel ne contient pas de dihydrogène. En revanche, ce milieu est une solution aqueuse acide, donc une solution contenant des ions H+.
Bonjour,
je ne sais pas comment écrire les formules en texte, donc je le met dans l'image en-dessous.
Cr2 O2-7 + 14 (H+) + 6 e- = 2 Cr3+ + 7 H2 O
et
Fe2+ = (Fe3+) + e-
résultat :
Cr2O2-7 + 6 Fe2++ 14H+ -> 2 (Cr3+) + 6 (Fe3+) + 7 H2O
Je ne comprend pas qu'on ait multiplié par 6, dans l'équation de Fe, on avait rajouté 1 électron pour équilibrer les 2 côtés.
Si on multiplie par 6, on aura
pour Fe(2+) : 6 * (2+) = 12 charges positives
pour (Fe3+).: 6*3 = 18 charges positives
et 6e- de chaque côté
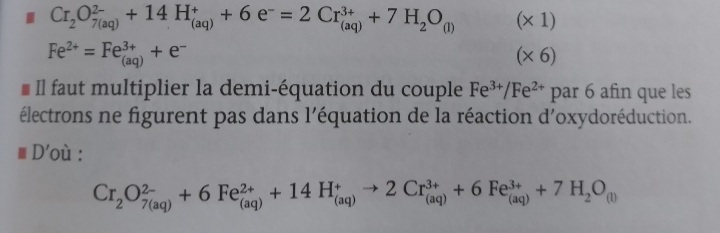
*** message déplacé ***
ah non en fait j'ai pas compris, on a enlevé le 6e- du côté des réactifs......
*** message déplacé ***
Bonjour
Tu ne peux pas effacer mais cela n'est pas grave. Une étourderie : cela peut arriver à tout le monde ! 
*** message déplacé ***
merci mais j'ai pas bien compris le lien que tu fais, en revanche voici l'équation :
Cr2 (O(2-)7) + 14 (H+) + 6e- = 2(Cr3+) + 7 H2O
en fait les + du 14(H+) servent à équilibrer les 2- 7 de l'oxygène?
Pourtant on utilise 6e- pour équilibrer avec les réactifs, alors je sais pas.
ok je pense avoir compris, on peut pas rajouter de charges positives seules, mais on peut rajouter des charges négatives seules.
en fait j'ai toujours pas compris, on a les 2 équations qui sont équilibrées, pourquoi multiplier par 6?
on dit "pour ne pas qu'ils apparaissent dans l'équation" ...
si un 6e- est de chaque côté, alors l'équation 6Fe2+ et 6Fe3+ n'est plus équilibrée...
*** message déplacé ***
Un ion Fe2+ en réagissant perd un électron alors qu'un ion dichromate en absorbe 6. Pour qu'il y ait autant d'électrons perdus que d'électrons absorbés il faut un nombre d'ions fer(II) réagissant 6 fois plus grand que le nombre d'ions dichromate.
*** message déplacé ***
Ok je comprend, mais je pensais qu'il fallait équilibrer les charges dans l'équation?
*** message déplacé ***
J'ai justifié dans mon message précédent pourquoi l'équation bilan s'obtient en multipliant par 6 les coefficients stoechiometriques de la demi équation faisant intervenir le couple Fe3+/Fe2+.
Je n'ai rien écrit sur la méthode permettant d'obtenir chaque demi équation.
*** message déplacé ***
Tu peux consulter cette fiche sur le forum qui explique la méthode générale d'obtention de l'équation bilan lors d'une oxydo-réduction :
![]() [lien]
[lien]
*** message déplacé ***
Bonjour,
c'était pas tout à fait la même question, mais ok, j'utilise le même sujet.
J'ai d'autres exemples d'équilibre des charges que je ne comprend pas, par exemple :
Br(O4-) + 2(H+) + 2e- = (BrO3-) + H2O
Le couple est Br(O4-) / BroO3-
On rajoute un O avec H2O, puis on rajoute 2H pour compenser, mais avec 2e- , ça fait 4- à gauche , et 3- à droite.
Autre exemple :
(MnO4-) + (8H+) + 5e- -> (Mn2+) + 4 H2O
Pour le couple MnO- / Mn2+.
On rajoute 4 O avec 4H2O, on compense avec 8H, pourquoi 5e- ? On a 1- à gauche et 2+ à droite.
Merci
Après avoir écrit la conservation de l'élément O en faisant intervenir les molécules d'eau et avoir écrit la conservation de l'élément hydrogène en faisant intervenir des ions H+, tu arrives à :
MnO4- + 8H+  Mn2+ + 4H2O
Mn2+ + 4H2O
Tu compte alors les charges :
à gauche : -1+8=+7 (il faut tenir compte des ions H+)
à droite : +2
Tu constates qu'il faut faire intervenir 5 électrons à gauche de façon à obtenir l'égalité :
+7-5=+2.
Essaye maintenant d'équilibrer la demi réaction correspondant au couple BrO4-/BrO3-



 ) :
) :

