Inscription / Connexion Nouveau Sujet
Incompréhension schéma de lewis et polarité
Bonjour, je poste aujourd'hui car je suis face à une incompréhension sur la notion de polarité.
J'ai été tout à l'heure confronté à un exercice qui attendait de moi de déduire la polarité d'une molécule à l'aide de son schéma de Lewis et de quelques indications sur l'électronégativité de ses atomes constituants.
Il s'agissait d'une molécule de dichlorodifluorométhane CCl2F2
J'avais personnellement effectué le schéma de Lewis comme suit :
F
|
Cl-C-Cl
|
F
(Je suis conscient qu'il manque les barres représentant les doublets non-liants sur mon schéma ci-dessus).
Or la correction affiche :
Cl
|
Cl-C-F
|
F
Je suis persuadé que les deux écritures sont correctes, l'ennui c'est que la correction de l'exercice semble déduire la polarité de la molécule seulement sur la base de ce schéma de Lewis, ce qui me semble absurde.
En effet, dans la correction, la géométrie de la molécule est déduite à partir du schéma, jusque là pas de problème. La molécule a une géométrie tétraédrique.
Et puis ensuite le fait que la molécule est polaire est balancé comme ça sans aucune explication.
Le fait que leur schéma de Lewis ne présente pas de symétrie invite effectivement à penser que les forces électriques ne se compensent pas, mais ça ne me paraît pas suffisant.
Et puis, dans mon schéma de Lewis de la même molécule, au contraire, la figure est symétrique, donc ça pourrait inviter à penser que la molécule est apolaire.
Donc je ne vois pas comment pourrait-t-on déduire la polarité d'une molécule à partir du schéma de Lewis, si plusieurs écritures de la même molécule sont valables et que ces différentes écritures changent les dispositions géométriques de la figure.
Pourtant je vois sur youtube des vidéos qui montrent comment déduire la polarité d'une molécule en déterminant le "centre géométrique" directement sur le schéma de Lewis.
Encore une fois ça me paraît absurde, sachant qu'il existe plusieurs schéma de Lewis possibles pour une molécule donnée, comment pourrait-t-on déduire des propriétés moléculaires à partir des propriétés géométriques d'un schéma qui n'est pas unique ?
En fouillant un peu, j'ai cru comprendre que la polarité d'une molécule dépendait de ses vraies propriétés géométriques(et non de celle d'un schéma de Lewis qui la représente).
Les différents atomes de la molécule s'agenceraient, si j'ai bien compris, en fonction de leur charge de sorte à minimiser leur répulsion électrique. Et, pour une structure donnée, on peut dire qu'elle est apolaire si les positions moyennes des charges partielles positives et négatives sont confondues.
Or, rien de tout ça n'est détaillé dans mon cours de première(j'étudie en autonomie), c'est à peine survolé, aucune quantification mathématiques ; enfin ça me paraît inapplicable en exercice à ce niveau, et pourtant, dans la correction de mon exo première de tout à l'heure, le fait que cette molécule est polaire est balancé comme une évidence. J'ai l'impression d'avoir loupé un truc.
Voilà, si quelqu'un peut m'éclairer là dessus : me confirmer que plusieurs schémas de Lewis sont valables pour une molécule donnée(sans parler des isomères) ; me confirmer qu'on ne déduit pas la polarité d'une molécule seulement avec son schéma de Lewis(sauf bien sûr dans le cas où tous les atomes ont la même électronégativité) ; m'éclairer sur cette notion de "centre géométrique" ou éventuellement me diriger vers les bons contenus.
Merci beaucoup pour votre temps.
Bonjour
Tu as déjà bien réfléchi aux divers problèmes posés par les notions de polarisation des liaisons et de polarité des molécules.
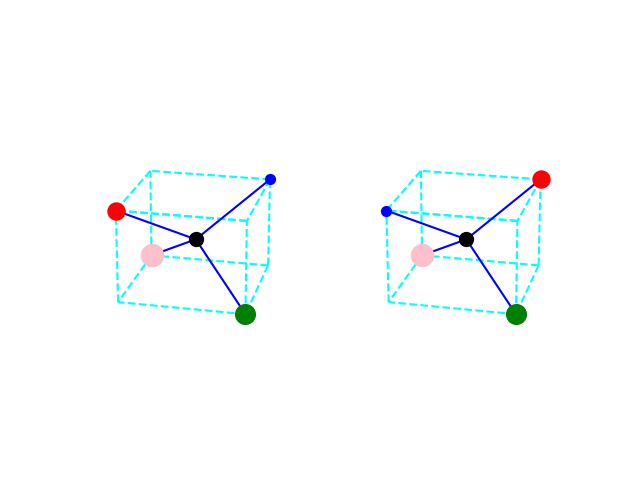
Un conseil : essaie de représenter ta molécule en 3D. Pour cela, commence par dessiner un cube en perspective en plaçant le noyau C au centre du cube. Place les quatre autres noyaux en utilisant 4 sommets sur les 8 du cube sans jamais utiliser deux sommets d'une même arête.
Ensuite, utilise ta méthode habituelle pour savoir si la molécule est polaire ou non.
Indication : la molécule CCl4 n'est pas polaire mais celle que tu étudies est polaire car F est un peu plus électronégatif que Cl...
Je te laisse réfléchir et poser d'autres questions si tu le juges nécessaire.
Bonjour,
Une fiche de cours de l'île pouvant s'avérer utile : ![]() De la structure à l'électronégativité des entités et à la polarité des molécules
De la structure à l'électronégativité des entités et à la polarité des molécules

Bonjour, merci pour vos réponses,
J'ai réalisé ce cube et ça m'a effectivement permis de mieux visualiser et de justifier par exemple de la polarité du dichlorodifluorométhane mais il y a toujours quelques zones d'ombres pour moi. Pour le dichlorodifluorométhane, étant donné qu'il n'y a que trois types d'atomes le constituant, tant qu'on met le carbone au milieu, peu importe comment on dispose les deux atomes de chlore et les deux atomes de fluor sur les 4 "emplacements libre" du tétraèdre(les 4 sommets du cube d'arrêtes distinctes pour reprendre ta représentation), les positions relatives des 5 atomes sont toujours les mêmes, et donc la polarité est toujours la même, mais dans un cas où il y a plus de trois types d'atomes, je ne vois pas selon quel principe disposer les atomes pour être sûr d'en avoir une représentation juste et enfin en déduire la polarité.
Sur la fiche du site, il n'y a aucun exemple pour déduire la polarité à partir de représentations géométrique en trois dimensions. Faut t-il se placer dans plusieurs plans de l'espace et vérifier que les vecteurs coplanaires entre eux s'annulent pour confirmer la non-polarité ?
Si deux moments dipolaires, donc deux vecteurs, sont non-coplanaires, alors ils ne peuvent pas s'annuler et la molécule est forcément polaire, je suppose ?
Ensuite dans mon cours il n'y a aucune méthodologie précise sur ces fameux vecteurs, leur norme notamment ? Je suppose que plus l'écart d'électronégativité est grand, plus le vecteur qui le représente est de norme élevée ?
Je trouve par endroit la mesure des angles formés par les différentes molécule, dans le cas de la molécule coudée par exemple. Ces valeurs sont-elles à retenir ?
Aussi pouvez-vous me confirmer que les deux représentations de Lewis mise dans mon premier message sont toutes les deux valables ?
Merci pour votre aide.
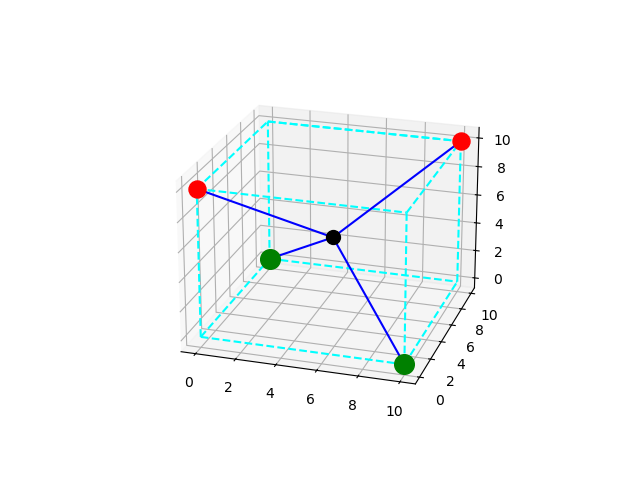
Les atomes de fluor (noyau représenté par une boule rouge) étant plus électronégatifs que les atomes de chlore (noyau représenté par une boule verte) les vecteurs polarisations associés au liaisons C-F doivent être représentés un peu plus long que les vecteurs polarisation associés aux liaisons C-Cl. La somme des quatre vecteurs polarisation n'est donc pas le vecteur nul. La molécule est donc polaire. Contre exemple la molécule CCl4 : les quatre vecteurs polarisation sont de même norme et leur somme vectorielle est nulle ; c'est pour cette raison que la molécule CCl4 est apolaire alors que les quatre liaisons C-Cl sont polarisées.
PS :
Je répondrai demain aux autres questions que tu viens de poser ...
Merci pour ta réponse. Pour le cas du CCl2F2 j'avais effectivement compris ce que tu me décris, mais en fait j'ai l'impression que je ne vais pas pouvoir transposer ce raisonnement pour chaque molécule à représentation tétraédrique.
Je m'explique :
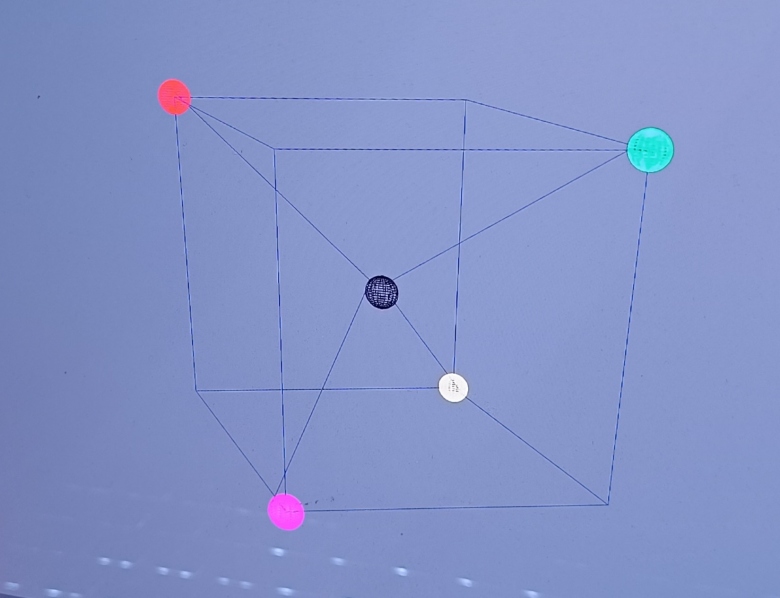
Je suppose qu'il existe des molécules tétraédriques composé de 4 voir 5 atomes distincts, alors, sur leur représentation tétraédrique, comment connaître la position relative correcte des différents atomes qui constituent la molécule tétraédrique, par exemple, supposons cette molécule fictive composés de 5 atomes distincts, je joins deux images.
On peut voir que je l'ai représenté de deux manières différentes, en permutant l'atome rouge et l'atome vert. Techniquement, ces deux représentations se déduisent du même schéma de Lewis, alors, comment savoir quelle représentation tétraédrique est la bonne ?
Quels sont les arguments qui justifient de la justesse d'une de ces deux représentations ? Pour un schéma de Lewis donné, quelles sont les règles qui définissent les positions relatives des différents atomes au sein d'une molécule(en particulier d'une molécule tétraédrique) ? Et est-ce que au final ça a une influence sur les propriétés de la molécule...
Je suppose qu'il existe des molécules(notamment tétraédriques) plus "compliqué", avec des vecteurs de longueur toutes subtilement différentes, et donc, dans ces cas là, il me paraît difficile d'avancer une réponse quant à leur polarité simplement en visualisant la figure, sur un coup de chance, il se pourrait que tous ces vecteurs se compensent parfaitement.
Je m'excuse pour cette avalanche de question, mais je n'ai trouvé aucune réponse à ces questions spécifiques...
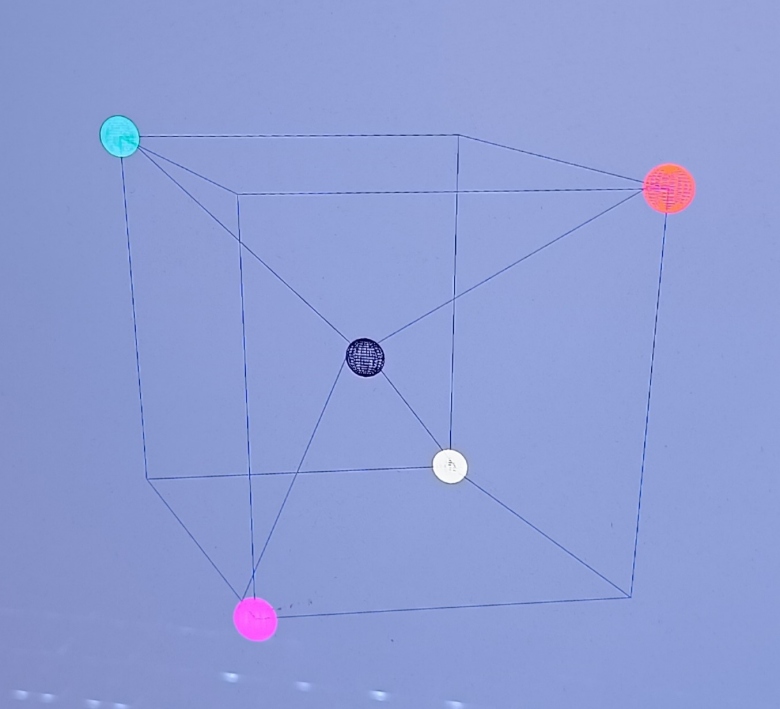
Il existe effectivement des molécules de type tétraédrique où l'atome de carbone central est lié à quatre atomes ou groupes d'atomes tous les quatre différents. Par exemple : CFClH. Dans ce cas, tu obtiens deux isomères comme le montre ton schéma. Ces deux molécules ne sont pas superposables mais sont image l'une de l'autre par un miroir plan, un peu comme ta main gauche qui est identique à l'image de ta main droite par un miroir plan. On parle de molécules chirales mais l'étude poussée de la chiralité se fait habituellement au niveau (Bac + 1). Je représente ci-dessous les deux molécules côte à côte pour mieux visualiser ce que je viens d'écrire. La réalité est un peu plus compliquée : les longueurs des liaisons ne sont pas tout à fait égales et les angles de liaison ne sont pas tous égaux à 109°28'.
L'étude de la polarité de la molécule se fait en représentant les vecteurs polarisation d'autant plus long que la différence d'électronégativité entre atomes liés est grande.
La seule chose à connaître par cœur : l'électronégativité augmente fortement de gauche à droite le long d'une ligne du tableau périodique et diminue lentement quand on descend une même ligne de ce tableau avec une exception : H est sensiblement de même électronégativité que C : couche de valence à demi remplie dans les deux cas. Ici la liaison C-H n'est pratiquement pas polarisée. La liaison C-F étant la plus polarisée, suivie de la liaison C-Cl et suivie de la liaison C-Br. Évidemment, dans ces conditions, la molécule est nécessairement polaire. La probabilité d'arriver à une somme vectorielle des vecteurs polarisation égale au vecteur nul est rigoureusement égale à zéro. Cette somme n'est nulle que si les quatre atomes liés à C sont identiques.