Inscription / Connexion Nouveau Sujet
exo de chim2
Bonjour a tous et a toute j'ai un exercice de physique sur les suivi temportel d'une transformation reationnelle et j'aimerai qu'on m'apporte de l'aide a traiter certaine questions et pour les questions que j'ai deja traité et qu'on me corriger
(les questions que j'ai faites apparaitront en bleue pour la clarté du correcteur )
Merci d'avance
Voici l'énoncé :
(Les parties II et III sont indédépendantes et peuvent etre traitée séparéement)
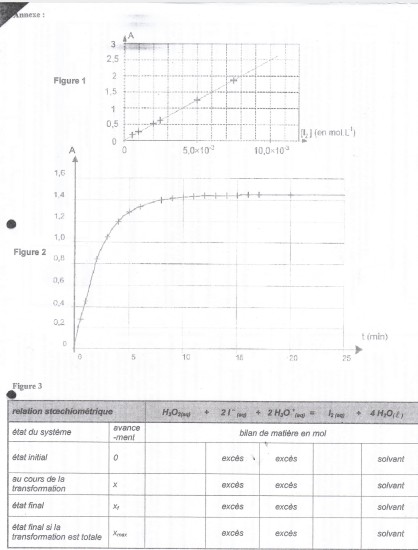
A. Courbe d'étalonnage du spectrophotometre
On a de 6 solutions aqueses de diodes de concentrations molaires apportées différentes. La mesure de l'absorbance A de chaque solution a été réalisée avec un spectrophtometre UV visible réglé a la longueur d'onde lamda=500 nm. Le spectrophometre utilisé admet une gamme de mesusre pour l'absorbance de A0=0 et Amax=2.00
et parmie les especes chimiques presente le diiode est la seule espece qui absobe a 500 nm. Les résultats obtenus permettent de tracer la courbe d'étalonnage de la figure 1 de l'annexe a rendre avec la copie.
1.Justifier a partir de la courbe d'étalonnage que les grandeurs portées sur le graphe sont liées par une relation de la forme A= k [I2].
ma réponse: Les grandeurs portées sur le graphe sont en effet liées par une relation de la forme A=k[I2] car elle vérifie la loi de beer lambert qui dit que pour pour les solutions dillués l'absorbance est proportionnelle a la concentration de l'espece responsable de l'absorption et que sa droite passe par zéro.
On note [I2]max la concentration molaire apportée en diiode au dela de laquelle l'aborbance d'une solution de diiode n'est pas mesurable qpar le spectrophometre utilisé ici.
2.DEterminer graphiquement la valeur de [I2]max en faisant clairement apparaitre la méthode utilisée sur la figure 1 de l'annexe a rendre avec la copie.
ma reponse: Par report graphique , on se place sur l'axe des abscisses et on remonte jusqu'à la la droite et on lit la valeur de [I2]max qui est d'environ 10.3x10^-3
b. Titre du lugol
Pour déterminer le titre en diiode du lugol , il est nécessaire de diluer 10 fois la solution commerciale s0.La solution obtenue est notée S0'. Le matériel mis a disposition est le suivant :
-béchers 50 ml ,100 ml,250 ml
-pipette jaugées 5..0 ml,10ml,20.0ml
-éprouvette graduée 10 ml, 20 ml, 100ml
Fiole jaugé 100.0 ml , 250.0 ml , 500.0 ml
1. Choisir , sans justification le matériel nécessaire pour préparer S0'
ma reponse: je n'ai pas trouvé laquel choisir
Sans modifier les réglages du spectrophometre on mesure l'absorbance de la solution S0: As'0=1.00.
2. Determiner graphiquement sur la figure 1 de l'annexe a rendre avec la copie la concentration molaire apportée en diiode de la solution S0'. On fera clairement apparaitre la méthode graphique utilisée.
ma reponse : c'est comme la A question 2 mais je ne sais pas comment repondre
3. En déduire la concentration molaire apportée c1 en diiode du Lugol (Solution commerciale S0)
ma reponse: Il me faut deja avoir la reponse de la B question 2 pour faire celle ci
4.Pourquoi a -t-il été nécessaire de diluer le Lugol (Solution de commerciale S0)?
ma reponse : ??
C.Etude cinétique d'une transformation chimique mettant en jeu l'eau oxygenée et libérant du diiode.
La transformation qui a lieu dans l'étude proposée est modélisée par la reaction dont l'equation l'équation d'oxydoréduction s'ecrit:
H202(aq)+2I-(aq)+2H30+(aq)=I2+4H20(l)
La mesrure de l'absorbance de diiode présent dans le milieu réactionnel a la longueur d'onde 500 nm permet de suivi l'évolution temporelle de diiode formé et de réaliser ainsi un suivi cinétique.La courbe A=f(t) est donnée sur la figure 2 de l'annexe a rendre avec la copie.
Afin de réaliser ce suivi cinétique:
.On prépare une solution S2(concentration c2) 10 fois moins concentrée que la solution S1 (concentration c1) d'eau oxygenée commerciale;
.On mélange dans un bécher , V=5.0 ml d'acide sulfurique et V3=9.0 ml d'une solution acqueuse d'iodure de potassium , K+(aq) +I-(aq);
.a l'instant de date t0=0s , on s'introduit rapidement , dans ce bécher , un volume V2=1.0 ml de la solution S2 d'eau oxygenée H202(aq).
.Un échantillon du milieu de l'experience , les ions iodure I-(aq) et les ions oxonium H30+(aq) sont introduits en excès par rapport a l'eau oxygenée.
1.Définir un oxydant
ma reponse : l'oxydant est une espèce chimique capable de capter au moins un électrons
2.Ecire les couple oxydant/reducteur mis en jeu dans la réaction étudiée et les demi -équations électroniques correspondantes.
ma reponse : de quel couple on parle ?
3.Completer littéralement , en utilisant les notations de l'énoncé, le tableau descriptif de l'évolution du systeme donné sur la figure 3 de l'annexe a rendre avec la copie.
4.A l'aide de ce tableau , établir l'expression de l'avancement x(t) de la reaction en fonction de [I2](t), la concentration molaire en diiode présent dans le milieu réactionnel et de Vtot le volume de mélange.
On rappelle que l'absorbance est liée a la concentration molaire volumique du diiode par la reaction A=k[I2].
5.Donner la definition de la vitesse de reaction v(t).On notera Vtot le volume du mélange réactionnel.
6.Montrer alors que : v(t)=1/k.dA(t)/dt
On note v0,la vitesse volumique de réaction a l'instant de date t0=0 min et v1 celle à l'instant de date t1=5.0 min.
7.a. Parmi les rélations données ci-dessous , choisir celle qui convient en justifiant graphiquement a partir de la figure 2 de l'annexe a rendre avec la copie
b.En faisant appel aux connaissance de cours , dire pourquoi v(t) subit cette évolution .Penser aux facteurs cinétiques.
--------------------
je reprends les questions ou je me suis arrêté donc voila : j'ai répondu aux questions ,j'aimerai bien qu'on me corrige le plus rapidement possible merci d'avance
partie C
question 2:
les couples redox sont h202/h20 et I2/I-
la demi équation de ce couple est : h202+2H++2e-=h20+h20
la demi équation : 2I-=I2+2e-
question 4:
j'ai répondu que la réaction en fonction de [I2](t) la concentration molaitre en diiode présent dans le milieu réactionnel et de Vtot est
nI2=x(t)
5.la définition de la vitesse de réaction v(t) est la suivante
La vitesse volumique de réaction est définie par la relation v(t) = (1/vtot) x (dx/dt(t))
questions 6 ;
pour cette question je ne comprends pas et j'aimerai qu'on m'aide , je sais qu'il faut remplacer le A par sa valeur littérale mais laquelle merci de bien vouloir m'aider.
question 7
a.J'ai dis qu'il s'agissait de v0<v1 car la vitesse de réaction est décroissante .
Ensuite ce la partie ou je n'arrive toujours pas a traité c'est la partie B question 3 et 4
partie B
question 2 A partir du graphique j'ai répondu que la concentration en diiode de la solution S'0 est d'après l'absorbance AS'0=1.00 est égale a une concentration de S'0 de 5.0x10^-3 d'après le report graphique.Comme je l'ai si bien mentionnée dans la question A 2
question 3
Je ne sais pas comment faire pour trouver la concentration en Lugol
J'opte pour le fait d'utiliser la formule n0=n1
donc j'attends confirmation de votre part .
question 4
j'ai besoin des réponses exacts des questions précédente pour traiter également cette question .
il faut diluer la concentration de lugol pour dimininuer la vitesse de reaction du milieu reactionnel
En espérant que quelqu'un m'aide 
mes reponses question 1
Les grandeurs portées sur le graphe sont en effet liées par une relation de la forme A=k[I2] car elle vérifie la loi de beer lambert qui dit que pour pour les solutions dillués l'absorbance est proportionnelle a la concentration de l'espece responsable de l'absorption et que sa droite passe par zéro.
mes reponses2
ma reponse: Par report graphique , on se place sur l'axe des abscisses et on remonte jusqu'à la la droite et on lit la valeur de [I2]max qui est d'environ 10.3x10^-3
première partie
1)la représentation graphique de A=f([I2])est une droite passant par l'origine,donc A=k*[I2] (k est la pente de la droite).
2)faire clairement apparaître la méthode utilisée signifie tracer sur le graphique les droites vertcale et horizontale utiles.
b)lugol
1)on utilise une pipette jaugée et une fiole jaugée.
Puisqu'on dilue 10 fois So,on peut choisir une pipette jaugée de 10mL et une fiole jaugée de 100mL (justification,bien que non demandée)
2)même remarque qu'au 2a
3)puisque So' a été obtenue en diluant 10 fois So,
[I2]So=10*[I2]S'o
4)avec la solution So,les capacités de mesure de l'absorbance auraient été dépassées(A>2 car la solution aurait été trop concentrée)
2ème partie
1)OK
2)OK ,mais respecte l'écriture des symboles (H et non h)
3) le tableau n'est pas fourni
4)x=n(I2)(t)
x=[I2](t)*Vtot
5)OK
question 7
a.J'ai dis qu'il s'agissait de v0<v1 car la vitesse de réaction est décroissante .
voici le scan peut tu me dire si j'ai juste ?
pourrais je savoir la valeur de S0 et S'0 car j'ai trouvé des valeurs qui ne sont peut pas les bonnes voir ci dessus par repport graphique .
6)si A=k[I2], dA/dt=k*d[I2]/dt
pour la question 6 de la partie C
vous me parler des relations de la questions 4 et 5 , je doi remplacer ? par les valeurs sur la formule donnée dans la question 6.
excusez moi je ne comprends pas
si 1 carreau  1,0.10-3mol/L,pour A =1,je lis C(S'o)=4,0.10-3mol/L
1,0.10-3mol/L,pour A =1,je lis C(S'o)=4,0.10-3mol/L
donc C(So)=4,0.10-2mol/L
sur la figure 2 tu dois tracer les tangentes à la courbe aus points d'abscisses 0 et 5min
la pente de la tangente au point d'abscisset=0 est plus forte que la pente au point d'abscisse t=5,donc v(o)> v(1).
La vitesse diminue car la concentration des réactifs diminue.(la probabilité de collision entre les réactifs diminue)
pour compléter le tableau,est-ce que les concentrations en H2O2 et I- sont données?
Si oui tu peux calculer n(H2O2)initial et n(I-)initial ,puisque leur volume est donné et compléter le tableau d'avancement
tu peux dire "tu".........
on a A=k[I2], dA/dt=k*d[I2]/dt
donc d[I2]/dt=(1/k)*d(A)/dt
or [I2]=x/Vtot
d[I2]/dt=(1/Vtot)*dx/dt=v(t)
donc
v(t)=1/k)*d(A)/dt
on nous pas les concentrations des quantités de n(H2O2)initial et n(I-)initial
mais on connait seulement leurs volumes , donc il faut simplement dire qu'il sont introduits en excès dans le tableaux d'avancement.
donc on ne peut calculer leurs quantités de matières.
Monsieur Coriolan pouvez vous également répondre a une question ou j'étais bloqué , il s'agit de la question 6 ou l'on nous demande :
6)"si A=k[I2], dA/dt=k*d[I2]/dt
pour la question 6 de la partie C
vous me parler des relations de la questions 4 et 5 , je doi remplacer ? par les valeurs sur la formule donnée dans la question 6."
excusez moi je ne comprends pas


