Inscription / Connexion Nouveau Sujet
Exercice sur les facteurs cinétique
Bonjour à tous, voici l'énoncé de l'exercice pour lequel j'aurais besoin d'aide.
" Quand on met en présence une solution de peroxodisulfate de potassiuem 2K+(aq) + S2O2-8(aq), une solution d'iodure de potassium K+(aq) + I-(aq), et quelques gouttes d'empois d'amidon, il apparait une coloration bleue."
1) Quelle espèce cette coloration met-elle en évidence ?
2) Ecrire l'équation de la réction, sachant que la réaction donne aussi des ions sulfates So2-4(aq).
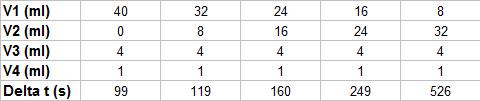
3) Dans un bécher au fond du quel on a dessiné une lettre, on effectue le mélange des deux solutions et on mesure la durée  t, au bout de laquelle la coloration bleue masque la lettre. On réalise, dans des bechers identiques, différents milieux réactionnels en mélangeant V1ml d'une solution de peroxodisulfate de potassium, 2K+'aq) + S2O2-8(aq) à c1=0.010 mol.L-1, V2 ml d'eau, V3ml d'une solution d'iodure de potassium, K+(aq) + I-(aq), à c3=1.0 mol.L-1 et V4ml d'empois d'amidon.
t, au bout de laquelle la coloration bleue masque la lettre. On réalise, dans des bechers identiques, différents milieux réactionnels en mélangeant V1ml d'une solution de peroxodisulfate de potassium, 2K+'aq) + S2O2-8(aq) à c1=0.010 mol.L-1, V2 ml d'eau, V3ml d'une solution d'iodure de potassium, K+(aq) + I-(aq), à c3=1.0 mol.L-1 et V4ml d'empois d'amidon.
a) Pourquoi est-il indispensable d'utiliser des béchers identiques ?
b) Calculer la concentration initiale en ions peroxodisulfate [S2O2-8]0 dans les divers milieux réactionnels.
c) Quel est le facteut cinétique mis en évidence?
d) Tracer le graphe de la fonction 1/ t = f([S2O2-8]0)
t = f([S2O2-8]0)
Que peut-on déduire ?
Mes réponses
1) Cette espèce met en évidence la formation de diiode par une coloration bleue.
2) Equation :
S2O2-8(aq) + 2I-(aq) = I2(aq) + 2SO2-4
3) a) Il ets indispensable d'utiliser des bechers identiques pour qu'il y ait les meme conditions d'expériences et pour que les solutions aient le meme volume.
b) à partir d'ici je bloque.
Merci de votre aide
Salut !
!
1) ok
2) ok
3) a) oui
b) c = n/V
c) tu modifies les volumes donc la concentration... Explique pourquoi la concentration est un facteur cinétique
d) ben là suffit d'appliquer la consigne... N'oublie pas le titre et l'échelle... Ensuite tu fais une observation qualitative
salut:
attention:
le peroxodisulfate de potassium c'est:
2K+ + S2O82- .
et les ions sulfates :
SO42-
donc l'équation de la réaction est:
S2O 8 2- + 2I- = I2 + 2SO42- plus les phases bien sure (aq)
b)pour Calculer la concentration initiale en ions peroxodisulfate [S2O2-8]0 dans les divers milieux réactionnels.
ultilises :no(S2O82-)=C1.V1=0,01mol/l.v2.10-3L
on aura:
V1 40 32 24 16 8
[S2O82-]0 4.10-4 2,4.10-4 1,6.10-4 0,8.10-4
c) le facteut cinétique mis en évidence est la concentration.
cette dernière question est male posée:
d) Tracer le graphe de la fonction  t = f([S2O2-8]0)
t = f([S2O2-8]0)
peut etre il s'agit de tracer :
[S2O82-]=f(deleta t)
C'est bien S2O82- et SO42-... Il manque les balises c'est tout
On voit bien que les moins s'appliquent au deux...
salut:
reste à répondre à la dernière question:
) Tracer le graphe de la fonction t = f([S2O2-8]0)
peut etre il s'agit de tracer :
[S2O82-]=f(deleta t)
on doit dresser le tableau d'avancement , puis calculer les différentes valeurs de [S2O82-] puis tracer la courbe.
salut:
non je ne pense pas ,pour cette raison j'ai demandé à
Mondededebo26 de revoir son énoncé pour bien savoir ce qui demandé.




