Inscription / Connexion Nouveau Sujet
exercice chimie reaction d'esterification
Bonjour, j'aurais besoin d'aide pour deux questions d'un exercice :
1. Écrire l'équation chimique de la réaction de synthèse de l'éthanoate d'éthyle sachant que le deuxième produit est du chlorure d'hydrogène.
2. L'ester formé possède-t-il un atome de carbone asymétrique ? Justifier la réponse.
Je n'y arrive vraiment pas
J'espère que quelqu'un va pouvoir m'aider, merci d'avance 
Question 1 :
La réaction classique pour synthétiser de l'éthanoate d'éthyle consiste à faire réagir de l'acide éthanoïque (ou acétique) sur de l'éthanol.
On obtient dans ce cas de l'eau comme deuxième produit.
Pour avoir un meilleur rendement on peut remplacer l'acide éthanoïque par un chlorure d'acide (ici le chlorure d'éthanoyle) . Dans ce cas le deuxième produit formé est du chlorure d'hydrogène.
Je te laisse, à partir de ce qui précède écrire l'équation chimique de cette synthèse.
Question 2 :
Il s'agit d'une question de cours qui nécessite seulement de savoir ce qu'est un carbone asymétrique et de vérifier si la molécule étudiée en possède un ou non.
merci d'avoir répondu
1) la formule de l'ethanol : CH3-CH2-OH
la formule de l'ethanoate d'éthyle : CH3-COO-CH2-CH3
et la formule du chlorure d'hydrogène est HCl
Pouvez-vous m'aider à partir de la?
Je ne comprends pas comment les mettre pour que ca donne l'équation chimique demandé
Comme le deuxième produit formé est du chlorure d'hydrogène le CHl doit être à droite mais sinon je ne sais pas...
merci d'avance
Les 3 formules que tu as écrites sont exactes.
Je suppose que tu connais les définitions des termes "réactif" , "produit" , synthèse
Si tu te donnes la peine de (re)lire mon précédent post tu n'auras pas de peine à distinguer les réactifs des produits.
Toujours en (re)lisant ce post tu constateras qu'il te manque un réactif dont tu n'as pas donné la formule.
Ayant alors les formules des deux réactifs et des deux produits je suggère que tu fasses une proposition de réponse que je rectifierai si besoin est.
Bonsoir,
Je pense que celui qui me manquait était le chlorure d'acétyle de formule : CH3COCl
Donc moi je dirais que ca donne :
CH3COCl-CH3-CH2-OH -> CH3-COO-CH2-CH3-HCl
Pouvez-vous me corriger si besoin s'il vous plait?
merci
Oui, le réactif manquant était bien le chlorure d'acétyle connu aussi sous le nom de chlorure d'éthanoyle.
L'équation de la réaction peut s'écrire :
CH3-CH2OH + CH3COCl  CH3-COO-CH2-CH3 + HCl
CH3-COO-CH2-CH3 + HCl
ou bien de manière plus précise :
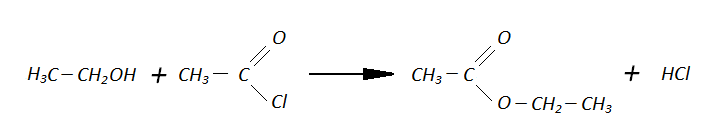
L'équation de la réaction que vous avez écris est-ce la même chose que ce moi j'ai écrit?
Parce que j'ai comparé et c'est juste l'emplacement des formules qui change mais les réactifs et les produits sont au même endroit... sinon merci pour l'équation plus précise 
Pour ma question 2, je pense que l'ester formé en possède un car il y a une liaison entre le carbone et le CH3 mais je ne suis pas sûre que c'est de cette manière qu'il faut l'expliquer...
merci
Il existe tout de même une sérieuse différence entre ce que tu as écris et ce que je propose.
J'ai mis un signe " + " entre les deux réactifs alors que tu les a réunis dans une seule molécule fictive qui ne correspond à rien de réel.
Et c'est exactement la même chose pour les deux produits.
CH3-CH2OH + CH3COCl  CH3-COO-CH2-CH3 + HCl
CH3-COO-CH2-CH3 + HCl
Je n'ai pas compris ton explication concernant la question 2
Tu donnes l'impression de ne pas savoir ce qu'est un carbone asymétrique.
Bonjour,
Un carbone asymétrique est un atome de carbone lié à 4 atomes ou groupes d'atomes différents
En effet, mon explication était pas clair et surement fausse mais dans l'ester formé, ije ne pense pas qu'il y ai de carbone asymétrique.
Ta définition du carbone asymétrique est exacte.
La molécule d'ester formée possède au total 4 atomes de carbone dont trois seulement sont liés à 4 atomes ou groupements d'atomes.
Mais aucun de ces trois atomes ne porte des atomes ou groupements d'atomes tous différents.
Tu as donc raison : La molécule étudiée ne possède pas d'atomes de carbone asymétriques.
merci 
J'ai d'autres questions dans cet exercice, j'espère que vous pourrez m'aider comme vous l'avez fait pour les questions précedentes.
1) Indiquer, dans la molécule de chlorure d'éthanoyle, quelles sont les liaisons polarisées ainsi que la localisation des charges partielles.
2) Identifier alors le(s) site(s) donneur(s) et le(s) site(s) accepteur(s).
Je l'ai fait pour la molécule d'éthanol mais pour celui là, je bloque...
merci d'avance
Je ne "veux" pas .
C'est toi qui décides.
Les questions qui te sont posées sont des questions de cours.
J'attends donc des propositions de ta part.
Je sais qu'un site donneur est un site avec un surplus d'éléctrons et qu'un site accepteur est un site avec un déficit d'éléctrons.
Une liaison covalente simple entre deux atomes est dite polarisées si les deux électrons mis en commun ne sont pas répartis de manière équivalente entre les atomes.
Je sais qu'une liaison entre deux atomes identiques est nécessairement non polarisée.
Mais sur l'éthanol c'était plus simple car il n'y avait que de l'hydrogène, oxygène et carbone. Là j'ai du mal avec le chlorure et le ch3 et du coup je ne comprends pas comment savoir si les liaisons sont polarisées.
Je sais que pour savoir ou sont les charges partielles, il faut voir quelle éléctronégativité est plus grande sauf que j'ai une tableeau qui indique l'electronegativité des atomes mais ce sont des groupes dedans et pas uniquement CH3 ou uniquement Cl et c'est pour ca que je ne sais pas par contre dans le C=O de la fin, je pense que C est une charge positive alors que O est une charge négative.
Je n'arrive pas à recopier la formule dans le forum mais je peux la dire :
CH3 - C (en dessous il y a Cl) = O
merci d'avance
La polarisation d'une liaison dépend de la différence d'électronégativité entre les atomes qui constituent cette liaison.
La molécule étudiée possède 4 liaisons .
Les 3 liaisons C-H ne sont (presque) pas polarisées parce que la différence d'électronégativité entre C et H est très faible.
La liaison C-C entre deux atomes identiques n'est (presque) pas polarisée.
Restent la liaison C=O et la liaison C-Cl
Les polarités de ces liaisons dépendent de la différence d'électronégativité entre atomes.
Il est très facile, pourvu qu'on cherche un peu, de se procurer ces électronégativités et de répondre à la question 1
C=O
C a une éléctronégativité de 2,5 alors que O a une éléctronégativité de 3,5
l'oxygène sera donc delta- et le carbone delta+
C - Cl
C a une éléctronégativité de 2,5 alors que Cl a une éléctronégativité de 3,16
le carbone sera donc delta+ et le chlore delta-
Je pense que les sites accepteurs sont le carbone et l'hydrogène et que les sites donneurs sont O et Cl
Est-ce exact?
D'accord pour le carbone, l'oxygène et le chlore.
La liaison C-H n'est (presque) pas polarisée . Relire à ce sujet mon post du 15-03-19 à 15:27
Il en résulte que les atomes d'hydrogène ne sont ni des sites donneurs, ni des sites accepteurs.
Ah oui, c'est clair maintenant merci 
Excusez-moi de vous poser une dernière question mais j'ai ce mécanisme réactionnel et j'ai beaucoup de mal avec ca même avec mon cours, je ne m'en sort pas... pouvez-vous me mettre sur une piste svp?
Mon énoncé me demande de placer une flèche courbe dans le mécanisme de la réaction.
C'est très embêtant le site ne veut pas insérer mon image avec le mécanisme...:/
Pouvez-vous quand même me donner une piste sur comment il faut que je procède svp?
merci d'avance
Désolé, mais sans l'énoncé complet de cette question et surtout sans image je ne peux rien te proposer.
Bonsoir,
Pour rebondir sur ce quà écrit mon collègue odbugt1, la seule chose que l'on peut te dire c'est que dans un mécanisme réactionel, les flèches courbes partent toujours d'un doublet d'électron pour arriver à une lacune électronique.
Si tu veux en savoir plus va falloir nous détailler ton énoncé!


