Inscription / Connexion Nouveau Sujet
Exercice Acides forts bases fortes
Salut à tous!
Je suis bloqué sur un exercice de chimie et je suscite votre aide svp.
L'enoncé
On dispose des solutions aqueuses suivantes:
► S1 une solution de chlorure de sodium de concentration molaire C 1 = 5 .1 0 -1 mol.L-1
► S2 une solution d'hydroxyde de calcium de concentration C2 = 8.10 -z mol.L-1.
► S3 une solution d'acide chlorhydrique de concentration C3 = 1. 10 -1mol.L
1 / Calculer le pH de chacune de ces solutions.
2/ On veut préparer 50mL d'une solution dont le pH = 5 en mélangeant un volume V 2 de S2 et V3 de S3.
Déterminer les valeurs V 2 et V 3 ainsi que la concentration de toutes les espèces chimiques présentes dans ce mélange.
3/ On mélange 20mL de S1; 30mL de S2 et 30mL de S3. Quel est le pH de ce mélange.
Ce que j'ai fait
Pour 1/ j'ai fait pH1= 7
pH2=pke +log 2C2 =13,2
pH3= -logC3= 1
2/ en utilisant pH = -log[H3O+] j'ai eu V2= 19,34mL et V3=30,66mL
3/ je sais pas quoi faire
Merci d'avance
Salut à tous!
Je suis bloqué sur un exercice de chimie et je suscite votre aide svp.
L'enoncé
On dispose des solutions aqueuses suivantes:
► S1 une solution de chlorure de sodium de concentration molaire C 1 =0,5mol.L-1
► S2 une solution d'hydroxyde de calcium de concentration C2 = 0,08mol.L-1.
► S3 une solution d'acide chlorhydrique de concentration C3 =0.1mol.L
1 / Calculer le pH de chacune de ces solutions.
2/ On veut préparer 50mL d'une solution dont le pH = 5 en mélangeant un volume V 2 de S2 et V3 de S3.
Déterminer les valeurs V 2 et V 3 ainsi que la concentration de toutes les espèces chimiques présentes dans ce mélange.
3/ On mélange 20mL de S1; 30mL de S2 et 30mL de S3. Quel est le pH de ce mélange.
Ce que j'ai fait
Pour 1/ j'ai fait pH1= 7
pH2=pke +log 2C2 =13,2
pH3= -logC3= 1
2/ en utilisant pH = -log[H3O+] j'ai eu V2= 19,34mL et V3=30,66mL
3/ je sais pas quoi faire
Merci d'avance
Bonjour
D'accord avec tes résultats de la question 1.
Pour 2 : je pense que tu as compris mais que tu as peut-être arrondi les calculs de façon maladroite. Personnellement, j'obtiens :
V2=19,2mL ; V1=30,8mL
Pour 3 : la raisonnement est très proche du précédent : tu as une réaction quasi totale entre les ions oxonium de l'acide chlorhydrique et les ions hydroxyde de l'hydroxyde de calcium mais cette fois-ci, ce sont les ions hydroxyde qui sont introduits en excès. Je te laisse réfléchir, tu devrais aboutir à :
Je te laisse finir...
Bonjour
3/ pourquoi vous n'avez pas utilisé la solution S1
Voila ce que j'ai fait
Après avoir calculer les concentrations de Na+ de Cl- et de Ca2+ j'ai utilisé l'equation d'électroneutralité et aboutir à une relation entre OH- et H3O+
[H3O+]=[OH-] - 0,225
Apres j'utilise le produit ionique
Et au finish j'ai eu pH=12,35. Je sais pas si c'est correcte et c'est un peu long
Ok merci
J'ai une autre question
Quels sont les avantages et les inconvénients du dosage phmétrique et ceux du dosage colorimétrique
Vaste question ! Quelques idées sans avoir la prétention de faire le tour de la question.
Un dosage pHmétrique, pour être précis, demande un matériel coûteux et surtout beaucoup de patience. Surtout au voisinage de l'équivalence, le pHmètre met du temps à se stabiliser, même si on utilise un agitateur.
Les dosages pHmétriques sont cependant indispensables. C'est de la courbe pH=f(v) qu'il est possible de déterminer l'indicateur coloré le mieux adapté, celui dont la zone de virage inclut le pH à l'équivalence. Ces dosages pHmétriques permettent aussi de déterminer certaines grandeurs caractéristiques des couples acide/base : le pKa en particulier.
En revanche, une fois connu l'indicateur coloré le mieux adapté, un dosage à l'aide d'un indicateur coloré est beaucoup moins coûteux en produits et en matériel et plus rapide. Pas trop rapide quand même : il faut verser très progressivement la solution titrante au voisinage de l'équivalence.
Je ne comprends pas trés bien on utilise un indicateur coloré pour le dosage avec le pH-mètre ?
C'est quoi exactement la différence entre le dosage pH-metrique et celui colorimétrique
Je ne comprends pas trés bien on utilise un indicateur coloré pour le dosage avec le pH-mètre ?
Non mais si on veut utiliser ensuite un indicateur coloré, il faut s'assurer que le pH à l'équivalence appartient bien au domaine de virage de l'indicateur coloré.
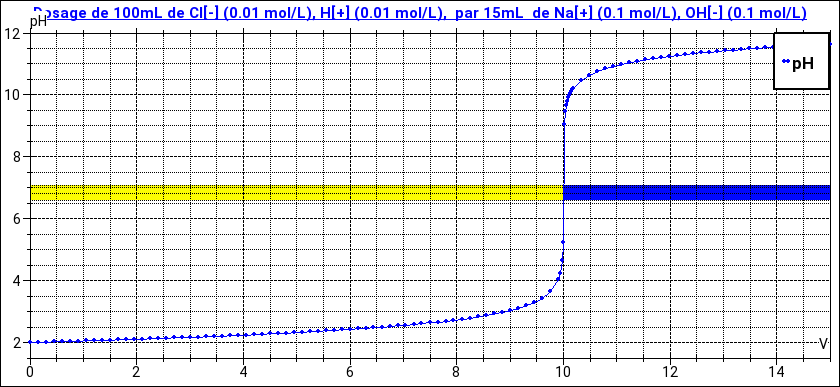
Le schéma ci-dessous illustre le dosage de 100mL d'acide chlorhydrique à 0,01mol/L par de la soude à 0,1mol/L. L'équivalence, c'est à dire le cas particulier où la quantité de soude ajoutée est égale à la quantité initiale d'acide, correspond à 10mL On voit bien que cette équivalence correspond à une brutale augmentation du pH, avec pH=7 à l'équivalence. Si une des deux concentrations était inconnue, on pourrait déduire le volume équivalent de cette courbe : c'est le volume correspondant à pH=7.
Une fois connu le fait que l'équivalence correspond à pH=7, pour faire d'autres dosages de type acide fort - base forte, on peut se passer de pHmètre. On ajoute à la solution acide quelques gouttes de bleu de bromothymol, indicateur qui passe de la teinte acide jaune à la teinte acide bleue pour pH voisin de 7. Le changement de couleur correspond à l'équivalence.
Tu vas avoir l'ocasion en cours et en TP d'étudier tout cela en détail.