Inscription / Connexion Nouveau Sujet
étude d'un vinaigre
bonjour, alors voilà : j'ai eut un DM de physique/chimie, 2 exo de chaque et manque de chance je bloque au 1er ^^ non pas que je veux pas passer au autre mais il m'on l'air tout aussi dure, voilà l'énoncer
Etude d’un vinaigre
L’étiquette d’un vinaigre du commerce, qui sera considéré comme une solution aqueuse d’acide
éthanoïque, inque 8° . Le degré d’acidité exprime la masse, en gramme, d’acide éthanoïque pur
CH3CO2H dans 100 g de vinaigre.
On se propose de déterminer au cours d’une scéance de travaux pratiques,la concentration C en acide
éthanoïque de ce vinaigre. La température de la salle est de 25°C. On dispose :
- d’une solution d’hydroxyde de sodium de
concentratin Cb = 0.1 mol/L
- de fioles jaugées de 50 ml, 100mL,
200mL,500mL avec bouchons
- de pipettes jaugées de
1mL,2mL,5mL,10mL,20mL et de poires
- des indicateurs colorés suivants
d’aspiration
- d’une burette graduée de 25 ml
- d’éprouvettes graduées de 10 ml, 20mL, 50mL
- béchers de 100 mL
- d’une pipette simple
- d’un dispositif d’agitation magnétique
- d’un pH-mètre et de solutions étalon
- d’eau distillée
indicateur :
hélianthine : 3,2 - 4,4
Rouge de méthyle : 4,4 - 6,2
BBT : 6,0 - 7,6
Phénolphtaléïne : 8,2 – 9,8
Données :
- Masse volumique du vinaigre 1.01 g/ml
- Masses molaires en g/mol MC= 12 ; MO = 16 ; MH = 1
- Ke = 10 –14 ( à 25 °C )
- pKa ( à 25°C ) des couples acides bases suivants
o Ion triméthylammonium [ CH3)3NH+] / triméthylamine[ (CH3)3N] pKa1= 9.9
o Acide éthanoïque / ion éthanoate pKa2 = 4.8
A. Dilution du vinaigre
On veut préparer une solution ( S ) de vinaigre de volume V=100mL, de concentration
en acide éthanoïque C1 = C/10
a) Quel volume de vinaigre faut-il prélever ?
b) Décrire le mode opératoire en précisant le matériel choisi.
B.Titrage pH-métrique de la solution (S)
On prélève un volume Va = 20,0 ml de la solution (S) que l’on dose avec une
solutiond’ hydroxyde de sodium. On mesure le pH en fonction du volume Vb de
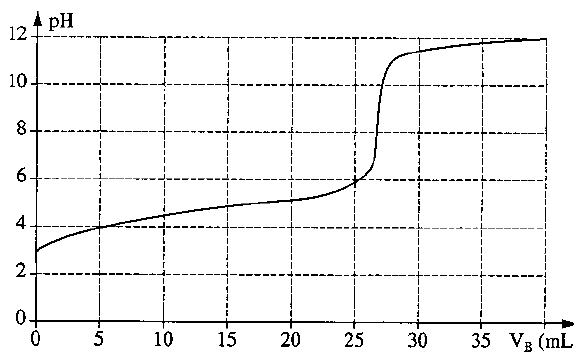
solution titrante versé. Les résultats ont permis de tracer le graphe ci-après.
Voir le graphe en annexe
a) Dresser la liste du matériel nécessaire pour réaliser le dosage.
b) determiner garphiquement les coordonnée du point d'équivalence.
c) si le titrage est réaliser sans mesure de pH, qu'elle indicateur choisir ?
d) Ecrire l’équation chimique associée à la transformation du système
étudié
e) Quelle est la quantité de matière d'ions HO- introduite dans la solution S lors d'un ajout de 20 mL de solution d'hydroxyde de sodium ? compte tenu de la valeur du pH de la solution S, détermine la quantité de matière de HO-. comparer les deux valeur
C. Une utilisation culinaire du vinaigre
Le poisson contient souvent de la triméthylamine (CH3)3N, d’odeur désagréable.
Lorsqu’on ajoute du vinaigre dans l’eau de cuisson du poisson au court bouillon,il se
forme des ions éthanoate et triméthylammonium. Une solution aqueuse d’éthanoate de
triméthylammonium est dépourvue d’odeur.
1.
Ecrire l’équation de la réaction acido-basique entre l’acide éthanoïque
et la triméthylamine
2.
Le pH du court bouillon étant acide, quelle est la forme du couple
CH3)3NH+/ (CH3)3N qui domine ?
3.
Quel intérêt présente l’ajout de vinaigre à l’eau d’un court bouillon ?
réponse :
I/
a) il faut prélevez 10 ml de vinaigre.
b) Matériel : pipette jauger de 10ml et une fiole jauger de 100ml.
Mode opératoire : prélevez 10 ml de vinaigre grâce à la pipette jauger de 10 ml et tout verser dans la fiole jauger de 100ml puis compléter jusqu’au trait de jauge avec de l’eau distiller.
II/
a) matériel : becher 50 ml, pH-mètre (étalonné), agitateur magnétique, burette de 50ml.
b) Point d’équivalence : Pe(26,5 ; 8,2)
c) La phénolphtaléine serait le plus approprier car sa zone de virage contient le pH à l’équivalence.
d) CH3CO2H / CH3CO2- H2O / HO-
CH3CO2H = CH3CO2-+H+
HO-+H+ = H2O _
CH3CO2H +HO- = H2O + CH3CO2-
e) la quantité de matière de HO- : n = m/M = 1,3.10-3 mol car la masse volumique de l’eau est de 1kg/L.
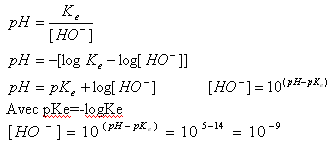
et c'est ici que sa bloque ^^, il reste encore 3 Questions dans la partie 2 mais je peu me debrouiller ^^.
merci pour votre aide
Edit Coll : images placées sur le serveur de l'  Merci d'en faire autant la prochaine fois !
Merci d'en faire autant la prochaine fois ! 
![]()
désoler pour le triple poste mais je trouve pas de fonction éditer : finalement je vous en pose une dernière : calculer la concentration en acide éthanoïque.
je sais que CaVa=CbVb, d'ou : Ca=CbVbe/Va bon, ok j'ai honte mais je bloque la ^^ je trouve pas le bon Cb, donc pas le bon Ca
help me, plz
slut cros. je pense à on avis que le bon Cb est donné dans l'énnoncé de l'exercice. C'est à dire Cb=0.1 mol/L. Et que le point d'equivalence a pour coordonnées: E(Ve=27,5 ml,PHe=11).


