Inscription / Connexion Nouveau Sujet
étude cinétique d'une réaction de saponification
Bonjour, j'ai un type bac a faire pour la rentrée mais je bloque dès la permière question...
Données
Masses molaires atomiques des éléments suivants : carbone :MC= 12.0 g/mol , hydrogène : MH= 1.0 g/mol ; oxygène MO = 16.0 g/mol
Masse volumique de l'ester E :  E= 0.880 g.cm-3
E= 0.880 g.cm-3
Masse molaire de l'ester E : ME = 116 g/mol
Pauline et Nicolas, élèves de terminale S, étudient expérimentalement la saponification d'un ester inconnu E au cours d'une séance de TP. Le but est de tracer la courbe donnant la concentration de l'alcool formé au cours du temps.
MODE OPÉRATOIRE
1. Les élèves mesurent un volume de l'ester E VE= 20.0 mL, qu'ils versent dans une fiole jaugée de 100 mL ; puis ils placent la fiole dans un petit cristallisoir contenant de la glace pilée. Ensuite, les deux élèves complètent jusqu'au trait de jauge avec une solution d'hydroxyde de sodium de concentration CB= 2.5 mol/l. On considérera la quantité de soude ajoutée comme suffisante pour que ce réactif soit en excès.
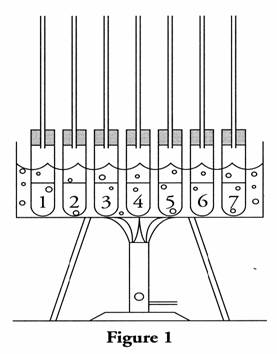
2. Après avoir bien agité le mélange des deux réactifs, ils en prélèvent, à huit reprises, un volume V0= 10.0 mL, qu'ils versent dans huit tubes à essais, numérotés de zéro à sept. Le tube zéro est maintenu dans la glace ; les tubes un à sept, après avoir reçu un réfrigérant à air, sont placés simultanément dans un bain-marie bouillant, à l'instant t = 0. Le chronomètre est déclenché à cet instant. Le montage obtenu est représenté figure 1.
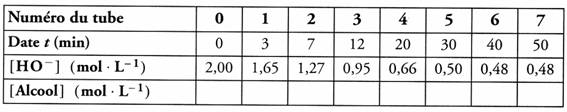
3. À des instants t convenablement choisis (voir le tableau, figure 2), les tubes sont sortis un à un du bain-marie et leur contenu est versé dans un bécher contenant 100mL d'eau glacée. On ajoute les eaux de rinçage.
Puis Pauline et Nicolas procèdent au dosage des ions hydroxyde restants à l'aide d'une solution d'acide chlorhydrique en présence d'un indicateur coloré judicieusement choisi. On admettra que le protocole de dosage ainsi choisi permet de doser les ions hydroxyde sans être perturbé par la présence des ions éthanoate. Ils procèdent de même avec le tube zéro. Les résultats obtenus sont regroupés dans le tableau, donné figure 2, à compléter ultérieurement.
QUESTIONS
I. L'analyse des produits formés montre qu'il s'agit d'ions éthanoate (ou acétate) et de butan-1-ol ; écrire l'équation de la réaction en utilisant les formules semi-développées et nommer l'ester E.
II - Questions sur le mode opératoire
1. Quelles précautions particulières faut-il prendre, à l'étape 1, dans la manipulation de la solution d'hydroxyde de sodium ?
2. Quelle verrerie conseillez-vous à Nicolas et Pauline pour mesurer le volume VE lors de l'étape 1 ?
3. Quelle est la concentration initiale de l'ester E dans chaque tube ?
4. Le refroidissement rapide de chaque tube avant le dosage porte le nom de trempe : quel est son but ?
III - Étude de la concentration en alcool en fonction du temps
On montre que la concentration de l'alcool dans chaque tube, à l'instant t, est donnée par :
[Alcool]t= [HO-](0) - [HO-](t)
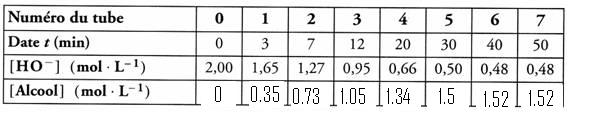
1. Compléter le tableau donné précedemment, à l'aide de cette relation.
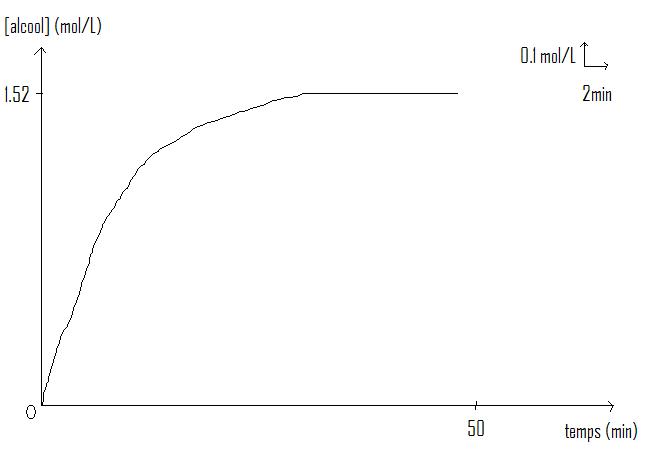
2. Tracer la courbe donnant la concentration de l'alcool en fonction du temps.
Échelle : 1cm pour 2min ;1cm pour 0.1mol/L .
IV - Exploitation du graphe
On fera le tracé le plus précis possible à l'aide de la règle graduée.
1. Déterminer la vitesse volumique de cette réaction à la date t=10min minutes (en mol/L/min ).
2. La réaction de saponification est-elle terminée à la date t=40 minutes ? Justifier.
3. Montrer qu'elle est totale.
V. Citer une application de la réaction de saponification.
pour I : C4H10O+CH3COO-= C4H9O-+CH3COOH => éthanoate d'éthyle ??
Merci de m'aider car je n'ai jaimais vu d'exercice de ce type avant :s
Il va falloir que je crée une touche de raccourci , m'évitant de réécrire ceci :
Salut!
Tu as fait quoi?
Yop Amandinouchet

je sais c'est très long, mais aussi assez dur, j'ai essayé la première question pendant 1/2h sans y arriver alors jme suis découragée...
jy regarderais encore demain, mais si vous pouviez me donner des pistes de réponses ça m'aiderait beaucoup
merci et bonne soirée
Re !
!
I) On te parle d'ions éthanoates et de butan-1-ol. Ca tu dois savoir le faire.
Ensuite par rapport à l'équation générale (je te renvoie aux fiches du site si tu veux), tu trouves les radicaux présents dans l'ester. Ok?
II) 1) c'est de la soude dc danger!
2) il faut que ce soit assez précis dc verrerie jaugée
3) je pense que c'est à ta portée
4) n'oublie pas que la température est un facteur cinétique. Arrêt de la réaction (ne pas oublier la description rapide au niveau de l'échelle moléculaire)
III) 1) T'as la relation et toutes les données nécessaires ds le tableau
2) je pense que tu peux faire.
N'oublie pas les échelles, le titre, les unités. Faut que le graphique soit propre
IV - Exploitation du graphe
On fera le tracé le plus précis possible à l'aide de la règle graduée.
1. Déterminer la vitesse volumique de cette réaction à la date t=10min minutes (en mol/L/min ).
2. La réaction de saponification est-elle terminée à la date t=40 minutes ? Justifier.
3. Montrer qu'elle est totale.
1) Tu traces l'asymptote. Entraîne-toi avant pour que ce soit propre et précis. Fais-le plusieurs fois pour avoir une moyenne approximative
2) Tu justifies à l'aide de l'allure de la courbe. Ne parle pas de courbe mais de ce qui varie
3) calcul du rendement
[i]V. Citer une application de la réaction de saponification.
Regarde dans ton cours, sinon tu as les fiches du site
Merci beaucoup Shadowmiko, mais pour la V je n'ai pas de cours là dessus, j'irai voir sur le site 
sinon pour I : C4H10O + CH3COO-= C4H9O- + CH3COOH ??
II 1/ blouse, lunettes, hotte? , gants
2/ pipette jaugée de 20mL ?
3/ calcul de dilution: VE*CB= C*V
20.10-3*2.5 = C* 100.10-3 ; C = 0.5 mol/L on divise par 8 : 0.06 mol/L ?? 
4/ but: arrèt de la réaction: les molécules ne réagissent plus entre elles