Inscription / Connexion Nouveau Sujet
estérification
Bonsoir s il vous j'ai besoin d'aide pour cet exercice.
1)Dans un ballon de 250 ml on plonge à température ordinaire une mole d'acide éthanoïque une môle de butan_2ol et en et 5 ml d'acide sulfurique pur. on répartit ce mélange entre 15 ampoules de verre scellé contenant le même volume réactionnel qui sont ensuite placés dans une étuve thermostaté à 100 °c. on prélève une ampoule à un instant donné et on dose 12 l'acide rethanoïque restant. Les résultats sont indiqués dans le tableau ci-dessous( nAC est la quantité d'acide éthanoïdes n'ayant pas réagi dans le mélange)
a) calculer le volume réactionnel total initiale. On donne les masses molaires et volumique suivantes: buntan2_ol :M1=74g/mol, u1=0,82g/ml ; acide éthanoïque M2=60 g/mol, u2= 1,83 g /ml
b) déterminer le volume de solution de soude de concentration molaire un mole par litre nécessaire pour atteindre l'équivalence acido-basique lors du dosage de la solution contenue dans l'ampoule prélevée à l'instant t=0
c) ecrire l'équation bilan de la réaction entre l'acide éthanoïque et le buton 2 _ol et donner les noms des produits obtenus
d) donner le nom de cette réaction et préciser ses caractéristiques
2)soit ne la quantité d'Ester formé au cours du temps .
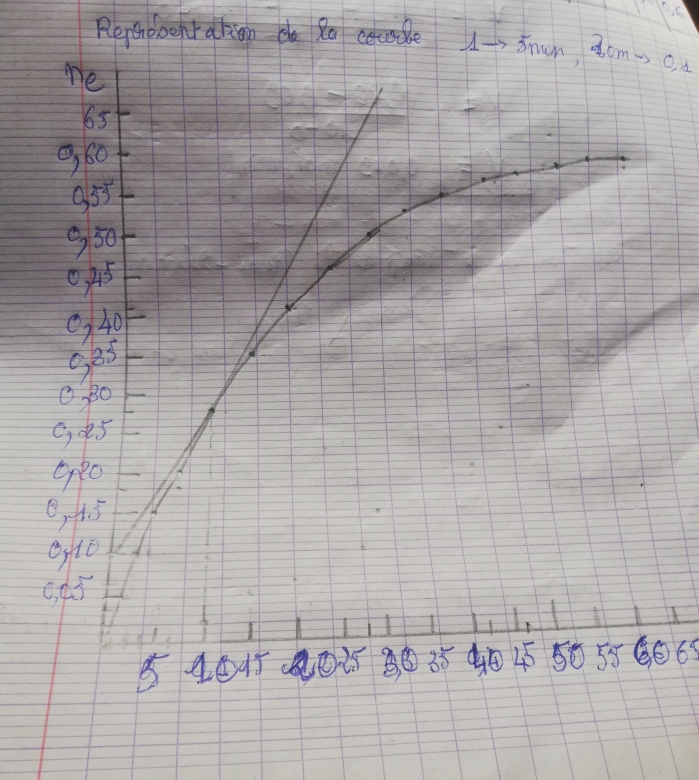
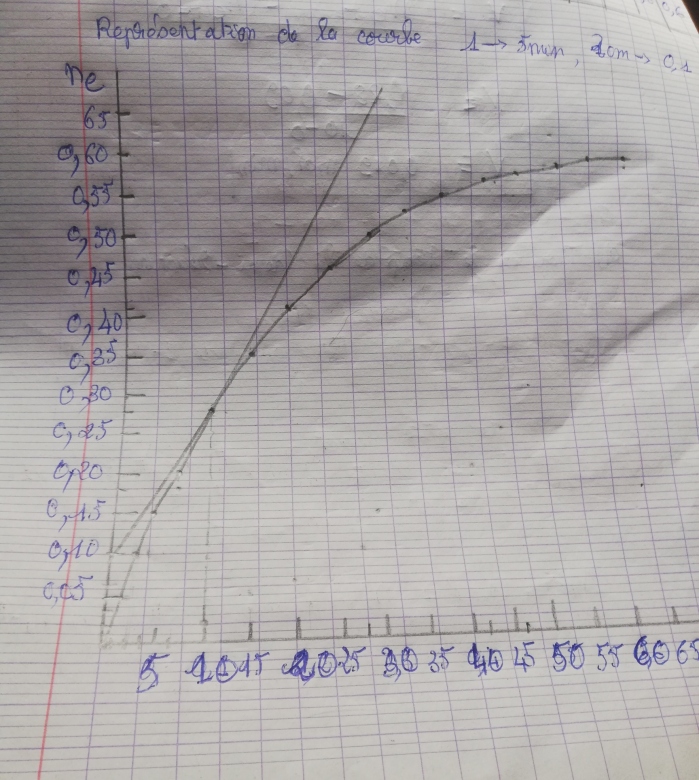
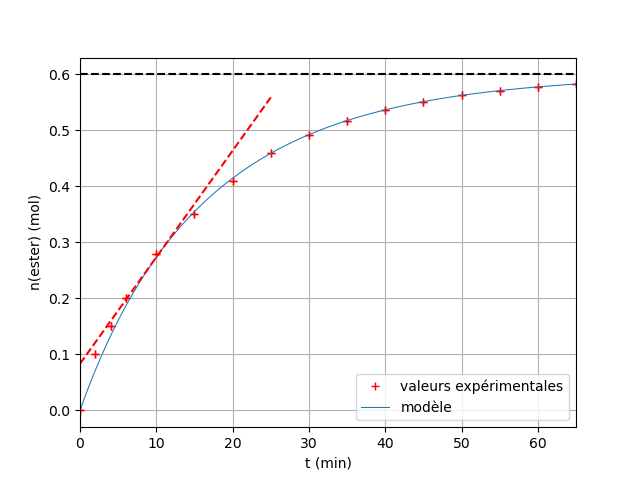
a) reproduire et compléter le tableau puis représenter la courbe ne=f(t)
b) indiquer la composition des mélanges relationnel à la fin de la réaction et préciser si la réaction est totale ou partielle
c) trouver la vitesse instantanée à la date t=10 minutes
d) trouver le temps de la de'i réaction.

Bonjour
Qu'es-tu réussi à faire pour l'instant ?
Si tu pouvais scanner et poster ici le tableau de mesures complété puis la courbe obtenue...
N'hésite pas à poser des questions précises sur ce que tu ne comprends pas.
Pour la question n°1 j'ai trouvé V=195,25ml
b) le volume de l soude = 1l
c)equation bilan=
CH3COOH+CH3-CH2-CHOH-CH3>CH3-COO-CHCH3-CH2-CH3+H20
le noms des produits : ethnoate de 1-méthylpropyle et l eau
Le nom de la réaction est le estérification se s caractéristiques lente, limitee et athermique
À la question 2) comment je vais procéder pour le calcul de l quantité d esters formé. Merci
Je n'obtiens pas ta réponse pour le volume initial total. Tu peux développer ton calcul ?
Pour b) la quantité initiale d'acide vaut (1/12) de mol par ampoule ; donc la quantité de soude pour obtenir l'équivalence vaut ?...
OK pour l'estérification
Ensuite : tableau d'avancement...
Pour commencer j'ai calculer le volume initial du butane 2ol
V1=m1/u1=74/0,81
V1=91,35ml
Acide ethanoïque
V2=m2/u2=60/1,83=32,78ml
Ensuite j ai fait la somme des trois volumes
V=V1+V2+Vh2so4
V=195,25ml
En faisant la somme des trois volumes que tu as calculés, on obtient 129mL, sachant que le volume d'acide sulfurique (catalyseur) vaut 5mL. Si on n'arrondit pas les calculs intermédiaires pour arrondir seulement le résultat final, on obtient 128mL.
Valeur numérique de Vb ?
D'accord, j'ai refais le calcul
Comment vous avez déterminer la quantité initiale de l'acide dans l'ampoule ?
J'ai mal lu l'énoncé avant de rédiger le message du 20-04-24 à 16:04.
Je reprends l'énoncé : si je comprends bien, le mélange initial contient 1mole d'acide éthanoïque dans 128mL. On répartit ce mélange dans 15 ampoules (pas 12 comme j'avais compris par erreur) , le volume étant le même dans chaque ampoule. Une ampoule contient donc initialement (1/15) mol d'acide éthanoïque.
Maintenant pour compléter le tableau
Le quantité d ester formé=quantité d'acide réagit donc on fait la quantité initiale d acide moins la quantité restant. C'est comme ça dois-je faire ?
Bonjour
Voici le tableau et la courbe
Pour la vitesse instantanée j'ai trouvé V=0,019mol/min
Le temps de l demi réaction t=30min

Le coefficient directeur de la tangente à la courbe en t=10min conduit à :
Qu'appelles-tu dans ton cours : “vitesse instantanée de réaction” ?
Vitesse instantanée c est la dérivé par rapport au temps de la quantité de matière formé à la date t considéré
Pour le temps de la demi réaction est ce correct ?