Inscription / Connexion Nouveau Sujet
équation titrage
Bonjour, pourriez vous m'aider à comprendre un problème récurrent?
On titre une solution de sulfate de fer II par une solution acidifiée de permanganate de potassium.
On cherche l'équation de réaction de ce titrage.
Comment savoir qu'est ce qui va réagir?
Je fais la liste des ions qu'on a : SO42-, Fe2+, MnO4-, K+ mais après?
Merci d'avance..
Les couples d'oxydo-réduction sont :
MnO4- / Mn2+
Fe2+ / Fe3+
Comment le sais-je ? J'ai bien peur d'être obligé de répondre qu'il faut le savoir...
Je ne suis pas un chimiste éminent mais je le sais  ...
...
Donc en fait il faut le savoir par coeur et il n'y a aucun moyen de trouver pour les couples?
De plus, pourquoi c'est eux qui réagissent?
(Déjà expliqué dans son autre post).
A ton niveau, il faut IDENTIFIER les éléments principaux pour regrouper les couples. Et pour savoir quoi réagit avec qui, tu regardes ce que l'on te donne au départ.
Après, les raisons calculatoires pour dire qui réagit avec quoi n'est pas de ton niveau. Mais en simplifié :
Pour avoir réaction, il faut que les réactifs respectent la règle du gamma et que la ddp soit > 0. Un critère sur les potentiels standards dit que si la ddp est Eo > 0.5V, on a une réaction totale. Mais je le répète, c'est pas de ton niveau.
On fournit normalement les couples sous la forme ox/red et donc pour le 2ème, je me suis trompé, c'est :
Fe3+ / Fe2+
On a : Fe2+ = Fe3+ + e-
Fe2+ est bien un réducteur parce qu'il fournit un électron.
Il faut savoir que MnO4- est un oxydant (puissant) et sa forme réduite est Mn2+ (puisqu'un oxydant est réduit et un réducteur est oxydé).
Donc, ici, MnO4- est réduit en Mn2+ et Fe2+ est oxydé en Fe3+
Il faut toujours ajouter des ions H+ (milieu acide) pour fabriquer de l'eau avec l'oxygène de MnO4-
"De plus, pourquoi c'est eux qui réagissent?"==> Pas au programme de terminale
Bonsoir Marc35,
Une précision, le couple MnO4-/Mn(2+) n'existe qu'en milieu acide. En milieu basique, c'est MnO4-/MnO2 (Solide verdâtre)
A présent je mets l'énoncé en entier :
Le titrage de 10,0 mL d'une solution S1 de sulfate de fer (II) par une solution acidifiée de permanganate de potassium donne un volume à l'équivalence V1éq = 13,3 mL. Le titrage de 20,0 mL d'une solution S2 de sulfate de fer (II) par la même solution de permanganate de potassium donne un volume à l'équivalence V2éq = 18,5 mL.
a. Quelle solution Sl ou S2 est la plus concentrée ?
b. Vérifier la réponse précédente en déterminant les deux concentrations, sachant que la concentration de la solution titrante utilisée est Cox = 2,00 .10-2 mol. L -1.
Le problème c'est qu'on a aucune concentration de donnée et on cherche c1 dans un premier temps (concentration de S1), qu'en pensez vous?
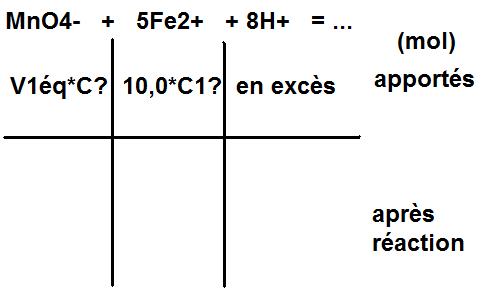
Bon je trouve que c'est S1 la solution la plus concentrée avec une concentration de 13,3.10-2 mol/L dans la question 2. Qu'en pensez vous? 
Tu sais qu'à l'équivalence,
n°Fe2+/k = n°MnO4-/j <==> CFe2+ = k/j*C(MnO4-)*Vag/Vo.
Tu sais que Vo2 = 2Vo1 et que Vag1 = 13.3 mL et que Vaj2 = 18.5 mL.
Donc, CFe2+(S2)/CFe2+(S2) = Vaj2*Vo1/(Vaj1*Vo2) = 18.5*Vo/(2*Vo*13.3) = 0.65 <==> CFe2+(S2) = 0.69*CFe2(S1) > CFe2(S1).
Donc, S1 est plus concentré que S2. C'est comme ça que l'on répond à la question 1.
b) Je te laisse faire.
k et j sont les coefs stchiométriques (Cf la relation d'équivalence). Et Vag est le volume ajouté de permenganate à l'équivalence.
Bon je trouve que c'est S1 la solution la plus concentrée avec une concentration de 13,3.10-2 mol/L dans la question 2. Qu'en pensez vous?
Je suis d'accord
Marc, wow ! merci de confirmer que j'ai résolu l'exo !
Boltzmann_Solver, ok, comme tu ne reprenais pas les notations de l'énoncé je ne voyais pas de quoi tu parlais.

L'énoncé ne donne pas de notations pour toutes les variables, donc, je peux prendre celle que je veux (j'aurai du les déclarer mais j'espérais que tu connaisses ton cours). Sinon, ta réponse est juste mais sans justification. Donc, en l'état, tu aurais 0 ou la moitié si le correcteur est très "gentil".
PS : Tu n'avais pas le droit d'utiliser les concentrations vu que c'était la question b).
J'ai jamais vu tes notations en cours.
J'ai juste mis la réponse pour avoir la vérification, si mon résultat avait été faux j'aurais alors écrit tous mes calculs.
@Romane : Si je suis aussi chiant (n'ayons pas peur des mots), c'est que tu peux arriver à une réponse juste sans utiliser le bon raisonnement. Donc, il est important de nous le communiquer de manière assez précise (énoncer les principes, règles, théorème, etc...)


