Inscription / Connexion Nouveau Sujet
Equation d'Etat desz gaz parfaits
Bonjour,
I ETUDE PREALABLE
• L'état macroscopique d'un gaz est décrit par 4 grandeurs: son volume V en m3, sa pression P en Pa, sa température T en K et sa
quantité de matière n en mol. Ces 4 grandeurs ne sont pas indépendantes: elles sont reliées par une relation appelée équation d'état.
• L'équation d'état la plus simple est l'équation d'état des gaz parfaits que l'on se propose d'établir.
1) Rappeler la loi de Boyle-Mariotte et ses conditions d'application.
• On place un pressiomètre et un thermomètre dans une cloche à vide dans laquelle on fait "le vide".
2) Le système étudié est l'air dans la cloche à vide. Comment a varié: la pression,
la température, la quantité d'air, le volume de l'air dans la cloche à vide ?
3) A T et V fixés, comment varie la pression P en fonction de la quantité de matière n ?
II EXPERIENCE
• Le montage expérimental est présenté ci-contre: une seringue en plastique
contient un volume V d'air constant. Elle est plongée dans un bain marie à la
température t (en °C) mesurée par un thermomètre. Un manomètre permet de
mesurer la pression P du volume d'air en fonction de la température.
• Remplir d'eau le récipient et y ajouter quelques glaçons. Immerger complètement
le corps de la seringue dans le récipient rempli d'eau. Ouvrir le robinet 3 voies pour
faire entrer un volume V d'air dans la seringue, puis fermer le robinet.
1) Quelles sont les deux grandeurs qui restent fixes dans l'expérience ? Quelles
sont les deux grandeurs qui vont varier ?
2) Copier le tableau suivant:
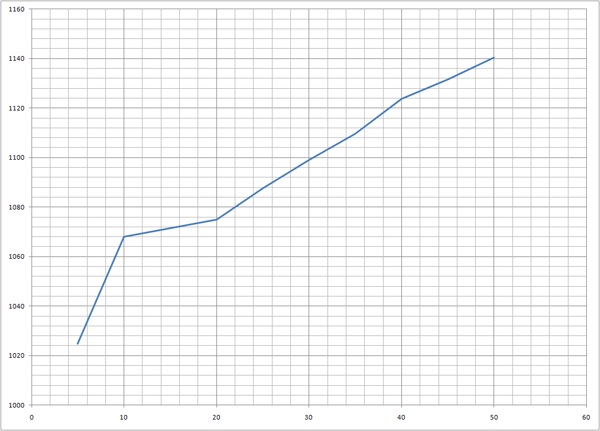
t(°C) 5 10 15 20 25 30 35 40 45 50
P (hPa)1024.7 1068 1071.4 1074.9 1087.8 1099 1109.7 1123.8 1131.6 1140.5
III EXPLOITATION DES RESULTATS
1) Graphe P = f(t)
a) Tracer le graphe P = f(t) avec t en °C, sur une demi-feuille de papier millimétré horizontale. Choisir des échelles pour avoir un
graphe le plus grand possible.
b) Quelle est l'allure du graphe ? Comment varie P en fonction de t ?
c) L'équation du graphe est de la forme: P = A.t + B. Calculer les valeurs de A et B en prenant P en Pa et t en °C.
d) Exprimer cette équation sous la forme: P = A.(t + C) et calculer la valeur de C.
e) On pose: P = A.T où T est la température absolue en K (kelvin). Quelle relation retrouve-t-on approximativement entre Tet
(t + C) ?
2) Équation d'état des gaz parfaits
a) On propose 4 relations qui lient: P, V, T et n:
(1) P.V = a.T / n (2) P.V = b.n / T (3) P.V = c.n.T (4) P.V = d / (n.T)
où a, b, c et d sont des constantes.
A partir des résultats du III montrer que l'on peut éliminer deux des quatre relations: lesquelles ?
b) A partir des résultats du I montrer que l'on peut éliminer une autre relation: laquelle ? Écrire la relation retenue.
c) Dans les conditions normales de température (T = 273 K) et de pression (P = 1,013.105 Pa) le volume molaire est:
Vm = 22,4 L.mol-1. Exprimer Vm en m3.mol-1 puis calculer la valeur de la constante, que l'on notera R dans la suite et que l'on appelle
constante des gaz parfaits.
d) En déduire l'expression de l'équation d'état des gaz parfaits.
J'ai fais lle grand 2 et a,b et c du 3 mais pour le reste je blocke merci de bien vouloir m'aider
Bonjour,
Le point (10;1068) est particulièrement faux...
Si on écrit P = A.(t + C) ==> B = AC de toute évidence...
Pour e, on doit avoir T = t + C
comment sa le point le 10 est faux ? avec une courbe linéaire prenant la moyenne le a 10° nous sommes à environ 1052
En c, on a calculé A et B donc C = B / A doit être faisable.
Quant à la courbe P = f(t), j'obtiens la courbe jointe.
Pour t = 10, on devrait avoir P = 1046 environ.
sauf erreur de ma part...
oué ta raison c'est que en fait en fesant l'exp en cour c'était environ mais avec une courbe linéaire on a calculé environ oui tu as raison se sont des valeur aproximative désolé
P = A t + B
P = A (t + C) = A t + A C
D'où B = A C ==> C = B / A
P = A (t + C)
et
P = A T
Donc T = t + C
On devrait trouver C = 273
2a)
Dans le III, on a montré que P est proportionnelle à T donc les relations 2 et 4 sont éliminées.
Dans le I, on a montré que P est proportionnelle à n donc la relation 1 est éliminée.
Il reste la relation 3 :
P.V = c.n.T
P = 1,013.105 Pa
V = 22,4 L.mol-1 = 22,4.10-3 m3.mol-1
n = 1
T = 273 K
Donc c = PV/nT = (1,013.105.22,4.10-3) / (1.273) = 8,3117948
A 3 chiffres significatifs, on a c = R = 8,31
Voilà...
Pour C, c'est mal parti... c = B / A = 1036 / 2,1 = 493 au lieu de 273


