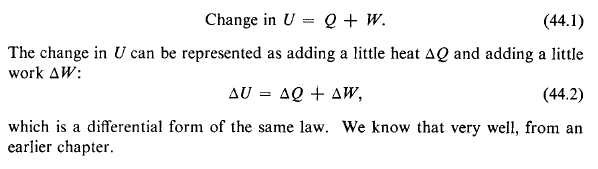Inscription / Connexion Nouveau Sujet
Entropie
Bonjour,
Concernant l'entropie, je cite wiki :
Cela devient, pour une transformation réversible effectuée à la température T constante :
Mais si la transformation n'est pas isotherme comment on fait ?
Pourquoi on a pas ?
Question bonus : Je vois souvent des notations differentes qui semblent vouloir dire la même chose, parfois on écrit et parfois
de même, on peut voir ou
ou encore
Je trouve ça déstabilisant... Quand est-ce qu'on utilise le ou la lettre seule ? quelle est la notation la plus correcte ?
Salut
Question récurrente !
la notation  Q/T ne veut pas du tout dire la meme chose que
Q/T ne veut pas du tout dire la meme chose que  Q/dt
Q/dt
On récapitule :
" " est utilisé pour une petite quantité
" est utilisé pour une petite quantité
"d" est utilisé pour une petite variation
" " est utilisé pour une variation "macroscopique"
" est utilisé pour une variation "macroscopique"
En conséquence, on ne verra jamais : " T" parce qu'une petite quantité de température ça ne veut rien dire. On ne verra jamais non plus
T" parce qu'une petite quantité de température ça ne veut rien dire. On ne verra jamais non plus  Q car on parlera d'une petite quantité de chaleur, pas d'une petite variation de chaleur.
Q car on parlera d'une petite quantité de chaleur, pas d'une petite variation de chaleur.
Je pense que tu as mal lu, on ne verra jamais écrit :  U =
U =  Q +
Q +  W
W
de même on ne verra pas S = Q/T mais bien  S = Q/T
S = Q/T
Ca t'éclaire ? si tu as encore des doutes, n'hésite pas
Prenons d'abord le texte en français :
la notation me gène, j'aurais effectivement mis  Se et
Se et  Sc. La preuve c'est qu'ensuite ils marquent bien
Sc. La preuve c'est qu'ensuite ils marquent bien  Sc, donc on peut parier au mieux sur une faute de frappe, au pire sur une non-constance dans les notations.
Sc, donc on peut parier au mieux sur une faute de frappe, au pire sur une non-constance dans les notations.
Pour le texte en anglais :
là c'est vraiment bizarre, on peut mettre ça sur le compte du fait que c'est plutot des notations anglo-saxonnes...
On te parle d'une forme différentielle, ce que nous on noterait avec le petit d pour le U et les petits delta pour W et Q. En tout cas je t'assure que les deux expressions mathématiques écrites feraient s'évanouir un prof de prépa 
En tout cas je t'assure que les deux expressions mathématiques écrites feraient s'évanouir un prof de prépa
 J'imagine...
J'imagine...
Mais outre ces notations farfelues, ce qui m'embête c'est que j'ai du mal avec le concept d'entropie. Je ne comprends pas bien la formule et du coup je peine à l'appliquer.
J'ai lu que
il va y avoir une augmentation d'entropie
mais qu'est ce que ça veut dire "à la température T" ? La température du système est susceptible de varier, si on le chauffe, non ?
si la température varie, comment je trouve
Et si
T est en fait la température de surface, là on se fait l'échange thermique Q. Dans le cas d'un échange avec un thermostat par exemple, T est bien constant.
Sinon dans le cas général, il faut intégrer : Se = 
 Q/T. Quand on intègre, si T est constant, on le sort de l'intégrale. Si T n'est pas constant, il faut connaitre l'expression de T en fonction du temps... je crois qu'on ne m'a jamais demandé de faire ça ^^
Q/T. Quand on intègre, si T est constant, on le sort de l'intégrale. Si T n'est pas constant, il faut connaitre l'expression de T en fonction du temps... je crois qu'on ne m'a jamais demandé de faire ça ^^
L'entropie s'échange entre les différents systèmes en présence lors d'une transformation thermodynamique. Mais il existe un écart entre l'entropie échangée lors d'une transformation parfaite (réversible) et une transformation réelle : ça correspond à l'entropie créée par la transformation