Inscription / Connexion Nouveau Sujet
Enthalpie molaire standard du Methanol (g)
Bonsoir,
J'ai un exercice ou je dois calculer l'enthalpie molaire standard de la réaction de synthese du méthanol.
J'ai cette équation :
CO(g) + 2H2 (g) = CH3OH (g)
Pour m'aider, j'ai les données des enthalpies des liaisons HH, CH, CO, OH et aussi de la molécule CO.
Je sais qu'il faut construire un cycle thermodynamique mais je n'y arrive pas.
Merci d'avance
Bonsoir,
Ton énoncé n'est pas très précis sur deux points :
l'énergie de liaison CO est l'énergie de la liaison CO de la molécule CO(g) ou de la molécule CH3OH(g) ?
"et aussi de la molécule CO" : pas très clair, non ?
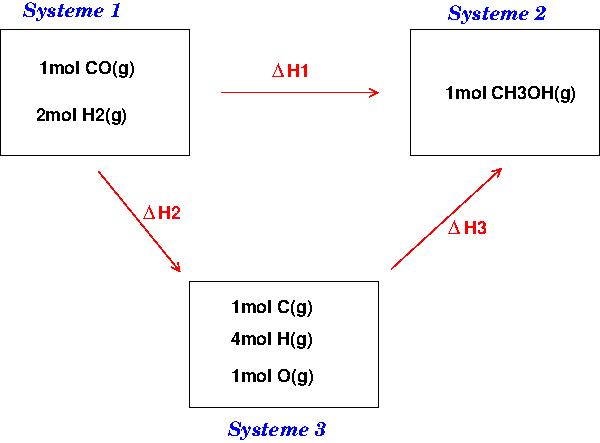
L'idée générale consiste à utiliser le fait que l'enthalpie est une fonction d'état. On imagine la transformation du système 1 au système 2 par deux "chemins" différents :
1° directement : la variation d'enthalpie est  H1
H1
2° en passant par le système 3 : la variation d'enthalpie est :  H2 +
H2 +  H3.
H3.
propriété des fonctions d'état :  H1 =
H1 =  H2 +
H2 +  H3
H3
Évidemment, tous les constituants figurant sur le schéma sont à la même température dans les conditions standard.
Il te reste à exprimer les variations d'enthalpie en fonction des données fournies.
Merci pour votre réponse rapide!
justement l'énoncé n'est pas clair et je ne comprends pas ce que représente la donnée liée à CO.
J'ai simplement un tableau avec
| Liason | Enthalpies |
| molécule CO | 1072 |
| H-H | 435 |
| C-H | 402 |
| C-O | 385 |
| O-H | 443 |
Dans le cycle que vous m'avez fourni il faudrait que je connaisse les enthalpies avec les corps purs etc. or je n'ai pas ces données dans l'énoncé du coup je ne pense pas que ce soit ce cycle à utiliser
Probablement que la première ligne correspond à l'énergie de la liaison C O de la molécule CO(g) alors que l'avant- dernière ligne correspond à l'énergie de la liaison C O de la molécule CH3COH(g)
Pour assurer l'homogénéité et ne pas mélanger les kJ/mol et les kJ , je pose ξ =1mol (avancement final de la réaction supposée totale) .
La variation d'enthalpie de la transformation directe 1 2 vaut :
2 vaut :  H1=ξ.
H1=ξ. rH°.
rH°.
L'étape 1 3 correspond à la coupure de 2 moles de liaisons H-H et à la coupure d'une mole de liaisons C 0 (liaison C O de la molécule CO(g))
3 correspond à la coupure de 2 moles de liaisons H-H et à la coupure d'une mole de liaisons C 0 (liaison C O de la molécule CO(g))
L'étape 3  2 correspond à la formation de 3 moles de liaisons C - H, 1 mole de liaisons O-H et une mole de liaisons C-O (liaisons de la molécule CH3COH(g)).
2 correspond à la formation de 3 moles de liaisons C - H, 1 mole de liaisons O-H et une mole de liaisons C-O (liaisons de la molécule CH3COH(g)).
Je te laisse faire les calculs. Dans ces conditions, on arrive à une enthalpie molaire de réaction :
 rH°=-92kJ/mol
rH°=-92kJ/mol
L'hypothèse que j'ai faite au départ sur les deux liaisons C O est très probablement correcte car les tables thermodynamiques classiques donnent à 25°C :  rH°=-91kJ/mol. Compte tenu des approximations faites et des arrondis de calcul, le résultat paraît très cohérent.
rH°=-91kJ/mol. Compte tenu des approximations faites et des arrondis de calcul, le résultat paraît très cohérent.
Deux remarques supplémentaires :
1° : J'ai supposé que les données numériques correspondent à des kJ/mol.
2° : Pour renforcer l'hypothèse faite , on peut remarquer que l'énergie de la liaison C O correspondant à la première ligne est "presque" le triple de l'énergie de la liaison C 0 de l'avant dernière ligne. Écris les formules développées des molécules CO et CH3COH et tu comprendras ...
étourderie : lire ma dernière phrase de la façon suivante :
Écris les formules développées des molécules CO et CH3OH et tu comprendras ...
J'ai commis la même faute de frappe également dans le message de 23h04. Désolé mais cela ne devrait pas t'empêcher de comprendre.
merci! il y a juste une dernière que je ne comprends pas, j'ai retenu que lorsqu'on coupait une liaison on arrivait forcement aux composés sous leurs formes corps purs dans leurs états le plus stable, or ici quand vous m'indiquez que je vais obtenir 4H(g) n'es-ce pas plutôt 2H2 (g) et si c'est le cas qu'es-ce que cela change?
merci! il y a juste une dernière que je ne comprends pas, j'ai retenu que lorsqu'on coupait une liaison on arrivait forcement aux composés sous leurs formes corps purs dans leurs états le plus stable, or ici quand vous m'indiquez que je vais obtenir 4H(g) n'es-ce pas plutôt 2H2 (g) et si c'est le cas qu'es-ce que cela change?
C'est bon enfaite j'ai compris mais je ne trouve pas le resultat que vous trouvez mais plutôt -993kJ/mol ce qui me paraît beaucoup...
J'ai utilisé la loi de Hess et fait ce calcul:
 H0 = LCO - (3 LCH + LCO + LOH )
H0 = LCO - (3 LCH + LCO + LOH )
et donc ça me donne 900 et des brouettes ...
Merci d'avance pour m'aiguiller
Bonjour,
Tu as oublié la transformation de H2(g) en atomes H. Examine à nouveau le schéma fourni hier à 20h42.
Selon moi :
j'ai retenu que lorsqu'on coupait une liaison on arrivait forcement aux composés sous leurs formes corps purs dans leurs états le plus stable,
Je crois que tu as tort : si on coupe toutes les liaisons on obtient des atomes. Je me demande si tu ne confonds pas ici atomes et corps simples.
Concrètement ici, pour obtenir la réaction 1
 2 on peut imaginer deux étapes :
2 on peut imaginer deux étapes :
- l'étape 1
 3 au cours de laquelle on casse toutes les liaisons y compris les liaisons des corps simples comme le dihydrogène.
3 au cours de laquelle on casse toutes les liaisons y compris les liaisons des corps simples comme le dihydrogène.
- l'étape 3
 2 au cours de laquelle on crée de nouvelles liaisons mais évidemment pas les mêmes qu'à l'état initial, sinon il n'y aurait pas de réaction chimique !
2 au cours de laquelle on crée de nouvelles liaisons mais évidemment pas les mêmes qu'à l'état initial, sinon il n'y aurait pas de réaction chimique !Le fait est, j'avais oublié H2 , merci beaucoup c'est beaucoup plus clair maintenant!
J'ai ensuite une autre question, on me demande de calculer la constance d'équilibre K0 de cette réaction a 523K, pour données j'ai en plus des précedentes,  rS0 = -243 J/mol/K et
rS0 = -243 J/mol/K et  rH0= -99,6kJ/mol
rH0= -99,6kJ/mol
Je ne peux pas utiliser Van't Hoff car je n'ai pas la constance d'équilibre de départ ni les concentrations des réactifs et je n'ai jamais utilisé l'entropie pour calculer ce genre de chose alors je ne vois vraiment pas comment faire..
Quelques éléments de réponses :
Les enthalpies standard et entropies standard de réactions sont probablement données à 25°C mais j'imagine que tu es habitué à utiliser l'approximation de Ellingham : tu considères les enthalpies standard et entropies standard de réactions indépendantes de la température sur tout intervalle de températures ne faisant pas intervenir de changement d'état physique des constituants intervenant dans la réaction étudiée.
merci! en effet c'était tout bête mais je ne connaissais pas cette loi.
La constante est bien en K-1 ?
La constante est bien en K-1 ?
Une constante thermodynamique est toujours sans dimension ; RT à la même dimension que l'enthalpie libre standard de réaction : une énergie molaire ; ln(K°) est sans dimension ainsi que K°.
Ah bon ? Je suis surprise, j'ai fait le calcul par analyse dimensionnelle.
Bon ba j'ai du me tromper, merci en tout cas!
Je suis surprise, j'ai fait le calcul par analyse dimensionnelle.
Pour l'analyse dimensionnelle, le plus simple est de partir de la relation suivante qui s'obtient de façon immédiate à partir des relations fournies aujourd'hui à 15h35 :


