Inscription / Connexion Nouveau Sujet
Accueil l'île de la physique - chimie Forum de physique - chimieListe de tous les forums de physique - chimie SupérieurOn parle exclusivement de physique/chimie, pour le supérieur principalement, les BTS, IUT, prépas... AutreForum autre de supérieur ChimieTopics traitant de Chimie [tout]Lister tous les topics de physique - chimie
Bonjour
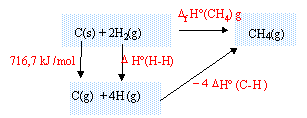
 H°(C-H) représente en fait l'enthalpie de dissociation de la liaison C-H. Donc si tu veux former une liaison C-H du méthane CH4, il faut que tu prennes l'inverse de
H°(C-H) représente en fait l'enthalpie de dissociation de la liaison C-H. Donc si tu veux former une liaison C-H du méthane CH4, il faut que tu prennes l'inverse de  H°(C-H) c'est-à-dire -
H°(C-H) c'est-à-dire - H°(C-H)
H°(C-H)
ok?

 :)
:)