Inscription / Connexion Nouveau Sujet
engrais commerciaux
Bonjour voilà j'ai un problème en chimie
Voilà l'énoncé:
L'utilisation intensive d'engrais commerciaux ainsi que les déjections animales favorisent la présence de nitrates dans le sol et par conséquent dans les nappes phréatiques.
Les fortes teneurs en nitrates dans l'eau du robinet peuvent causer das problèmes de santé, en particulier chez les bébés et les femmes enceintes, d'où la nécessité de contrôler la qualité de l'eau.
On se propose de déterminer la concentration molaire en ions nitrates d'une eau du robinet par conductimétrie, afin de savoir si les normes de potabilité sont respectées.
I - Préparation des solutions diluées
On prépare une solution notée S0 en dissolvant un volume d'eau distillée V = 1000mL, une masse m de nitrate de potassium solide KNO3(s) égale à 1.01g.
1. Écrire l'équation de dissolution du nitrate de potassium dans l'eau.
2. Quel est le rôle de l'eau lors de la mise en solution d'un solide ionique ? vous vous aiderez de schémas légendés.
3. Calculer la concentration molaire en soluté apporté C0 de la solution mère S0 en mol.L-1 et en mmol.L-1.
4. Quelle relation y a - t - il entre la concentration molaire en soluté apporté et la concentration molaire effective en ions nitrate ?
On désire préparer 6 solutions diluées Si de volume Vfille = 1000mL, à partir de la solution mère, dont les concentrations molaires en soluté apporté Ci sont reportées dans le tableau ci-après.
5. Calculer, pour chaque solution fille, le volume V0 de solution mère à prélever. Recopier et compléter le tableau ci-dessous :
| Solution | S0 | S1 | S2 | S3 | S4 | S5 | S6 |
| Concentration Ci(mmol.L-1) | .... | 2.00 | 1.50 | 1.00 | 0.500 | 0.200 | 0.100 |
| Volume à prélever (mL) | .... | .... | .... | .... | .... | .... | .... |
| I (mA) | .... | 0.870 | 0.670 | 0.410 | 0.218 | 0.0850 | 0.0460 |
| U(V) | .... | 1.50 | 1.50 | 1.50 | 1.50 | 1.50 | 1.50 |
| G(mS) | .... | .... | .... | .... | .... | .... | .... |
II _ Mesure de conductance
En l'absence d'ions Nitrates NO3-(aq), l'eau du robinet a une conductance Ga égale à 600 µS. Cette conductance est due aux ions sodium magnésium, calcium, sulfate, chlorure, etc ...
On plonge dans chaque solution fille, une cellule de conductimétrie aux bornes de laquelle on branche un voltmètre et un ampèremètre. Les valeurs de l'intensité I et de la tension U sont consignées dans le tableau précédent.
1. Calculer pour chaque solution diluée la valeur de conductance G et remplissez le tableau.
2. Tracez le graphique représentant la conductance en fonction de la concentration molaire en soluté apporté.
On prélève dans un bêcher de l'eau puis on relève la valeur Gb de la conductance: Gb = 815 µs.
3. Peut on à partir de la conductance, Gb de l'eau du robinet, déterminer la concentration molaire en ions nitrates de l'eau du robinet ? justifier.
4. Quelle est la valeur de la conductance Gc de l'eau du robinet due aux seuls ions nitrate et potassium ?
5. En déduire la concentration molaire Cnit en ions nitrate de l'eau du robinet. Vous utiliserez 2 méthodes différentes.
6. Calculer la concentration massique tm en ions nitrate, exprimée en g.L-1 puis en mg.L-1 dans l'eau du robinet.
7. L'eau du robinet est elle potable ?
Données: Masses molaires en g.mol-1 Mk=39.1; Mn=14.0; Mo=16.0
Concentration massique tm maximale autorisée en ions nitrate: 50mg.L-1.
Merci d'avance pour votre aide.
beh pour la 1 ouais :
KNO3(s) k+(aq) + NO3-(aq)
k+(aq) + NO3-(aq)
Pour la 2 l'eau c'est le solvant mais j'ai pas d'idée pour les schémas
1) ok
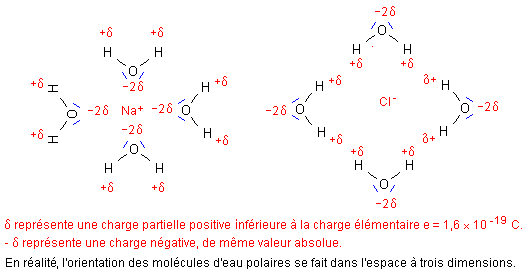
2) Les molécules d'eau, polaires, exercent sur le cristal des forces électriques qui dissocient le cristal ionique. La dissolution du composé solide s'effectue en deux étapes :
- dissociation du cristal en ions séparés
- et solvatation des ions (voir schéma ci-dessous)
sont suivies de la dispersion des ions solvatés dans tout le volume occupé par le liquide.