Inscription / Connexion Nouveau Sujet
Doublets liants et non liants règle de Lewis
Bonjour à tous 
Je ne comprends rien à la règle de lewis, les doublets liants et les doublets non liants.
Pouvez me l'expliquez clairement et simplement ?
merci d'avance
Bonjour,
Les électrons se répartissent sur des couches autour du noyau.
La première couche K accepte au max 2 électrons
Les suivantes L et M en acceptent 8.
Les électrons se repartissent en remplissant d'abord la couche K.
Puis sur la couche L tu vas imaginer qu'il y a 4 doubles sièges.
Ils vont se repartir d'abord en se mettant 1 par siège, puis les suivant comblent les sièges vides.
Tous les électrons assis "en couple", forment les doublets non liants ( il n'y a plus de place sur le siège)
Les électrons assis seuls , sont des électrons célibataires. Ils vont pouvoir accepter les électrons d'un autre atome qui vient compléter les places vides. Ils formeront aussi un couple mais qui aura attaché les deux atomes. C"est un doublet liant.
En effet les atomes détestent avoir des sièges vides...c'est la règle de l'octet ( ou du duet pour l'hydrogène)
Prenons un exemple:
Le Chlore Cl, possede 17 electrons.
la repartition electrnique est : (K)2(L)8(M)7
Sur la dernière couche ( la seule qui nous intéresse) il y a 7 électrons. Le max est 8 ( 4 doubles sièges)
Ils se sont placés ainsi :
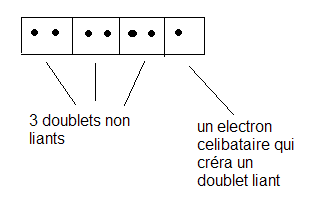
tu vas donc représenter la molécule en dessinant un petit trait pour chaque doublet non liant et un point pour l'électron célibataire ( c'est la représentation de Lewis)
_
|Cl
ok?


