Inscription / Connexion Nouveau Sujet
Dosage: exo type bac
Bonjour, j'ai à faire un exercice de chimie sur les dosages et je bloque vers le milieu de l'exercice; voici le sujet (si vous connaissez les balise de couleur merci de me le dire pour les réponses):
Dans cet exercice, on étudie l’évolution temporelle de la réaction d’oxydation du propan-2-ol par les ions permanganate. Cette réaction aboutit lentement à la formation de la propanone. L’équation (1) associée à la réaction s’écrit :
5C3H8O(aq) + 2MnO4–(aq) + 6H+(aq) = 5C3H6O(aq) + 2Mn2+(aq) + 8H2O(l) (1)
La transformation associée sera considérée comme totale.
Préparation du mélange réactionnel :
On introduit dans un erlenmeyer 50,0 mL d’une solution de permanganate de potassium de concentration co = 0,20 mol.L-1 et 50,0 mL d’une solution d’acide sulfurique en excès.
On place l’erlenmeyer sous agitation magnétique.
À l’instant t = 0, on ajoute 1,0 mL de propan-2-ol au contenu de l’erlenmeyer.
Étude de l’évolution de l’avancement :
Afin de représenter la courbe qui traduit l’évolution de l’avancement x de la réaction au cours du temps, on prélève à l’instant t, un volume V = 10,0 mL du mélange réactionnel que l’on verse dans un bécher contenant 40 mL d’eau glacée.
On titre ensuite les ions permanganate contenus dans le bécher par une solution de sulfate de fer II de concentration c’ = 0,50 mol.L-1. Le volume équivalent V’E obtenu permet ensuite d’en déduire l’avancement x de la réaction d’oxydation de l’alcool à l’instant t.
On renouvelle l’opération à différents instants et on trace la courbe donnée en annexe.
Données :
• Propan-2-ol :
Masse volumique :
 = 0,785 g.mL-1 ;
= 0,785 g.mL-1 ;
Masse molaire : M = 60,0 g.mol-1 ;
• Couples oxydant/réducteur qui interviennent :
Fe3+(aq)/Fe2+(aq) ; MnO4–(aq) / Mn2+(aq)
C3H6O(aq) / C3H8O(aq).
• On rappelle que l’ion permanganate MnO4– a une coloration violette en solution aqueuse. L’ion manganèse Mn2+ est incolore.
1. Étude de la réaction support de titrage (réaction 2).
1.1. Pourquoi a-t-on introduit chaque prélèvement dans 40,0 mL d’eau glacée ?
On a introduit chaque prélèvement dans 40,0 mL d’eau glacée pour stopper le réaction pour représenter un courbe qui traduit l'évolution de l'avancement x de la réaction au cour du temps
1.2. Montrer que l’équation (2) support de titrage est :
MnO4–(aq) + 8H+(aq) + 5Fe2+(aq) = 5Fe3+(aq) + Mn2+(aq) + 4H2O(l) (2)
On a les deux couples Fe3+(aq)/Fe2+(aq) ; MnO4–(aq) / Mn2+(aq);
Donc on écrit les demis équations: Mn04- + 8H+ + 5é = Mn2+ + 4H2O et Fe3+ = Fe2+ + é
On en déduit l'équation d'oxydoréduction: MnO4–(aq) + 8H+(aq) + 5Fe2+(aq) = 5Fe3+(aq) + Mn2+(aq) + 4H2O
1.3. Définir l’équivalence du titrage. Comment repère-t-on l’équivalence ?
L'équivalence du titrage sera quand Mn04- et Fe2+ (les réactifs) seront totalement consommés. On repère l'équivalence par un changement de couleur de la solution.
1.4. Exprimer la quantité d’ions permanganate dans le prélèvement à l’instant t en fonction de c’ et V’E.
nMnO4- = C'* V'E
2. Étude de la réaction principale (réaction 1).
On peut considérer que la quantité n d’ions permanganate à l’instant t dans le mélange réactionnel est :
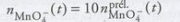 .
.
2.1. Exprimer puis calculer les quantités initiales d’ions permanganate et de propan-2-ol dans le mélange réactionnel que l’on notera respectivement
 .
.
nMnO4-=C0 * V = 0,20 * 50.10-3 = 1.0.10-2mol
npropan-2-ol = (
 *V)/M = (0,785 * 1,0.10-3)/60 = 1,31.10-5mol
*V)/M = (0,785 * 1,0.10-3)/60 = 1,31.10-5mol
Là je n'en suis pas sûr car j'ai pas trop compris l'histoire du
 .
.
2.2. Compléter, avec des expressions littérales, le tableau d’avancement de la transformation associée à la réaction 1 fourni en annexe à rendre avec la copie.
Je continuerais si la question précédente est juste
2.3. Calculer l’avancement maximal de la réaction. Quel est le réactif limitant ?
2.4. Exprimer l’avancement x de la réaction en fonction de , c’ et V’E.
3. Temps de demi-réaction.
3.1. Définir, à l’aide d’une phrase, le temps de demi-réaction t1/2.
3.2. La courbe représentant l’évolution de l’avancement de la réaction 1 en fonction du temps est donnée en annexe à rendre avec la copie.
Déterminer t1/2.
Edit Coll : images placées sur le serveur de l'
 Merci d'en faire autant la prochaine fois !
Merci d'en faire autant la prochaine fois ! 
l'eau glacée permet de stopper quasiment la réaction entre MnO4- et le propanol.
Sans cette trempe,le dosage des ions MnO4- non réduits serait faussé ,car la qté de matière d'ions MnO4- dosée serait inférieure à celle contenue dans le volume prélevé,au moment du prélèvement
1.2 OK
1.3
l'équivalence est atteinte quand les réactifs sont mélangés dans les proportions stoechiométriques,c'est à dire
n(MnO4-)/n(propanol)=1/5
mais ta réponse est valable
1.4 OK
2.1 OK
tu as en effet calculé no(MnO4-) et no(propanol)
tu peux continuer
réctification
les proportions stoechiométriques sont 2/5 puisque dans l'équation on a 2 MnO4- pour 5 propanol
j'ai regardé cela un peu vite!
la qté de matière de propanol est fausse
n=m/M = *V /M =0,785*1/60=1,31.10-2 mol
*V /M =0,785*1/60=1,31.10-2 mol
en effet si  est en g/mL ,V doit être en mL
est en g/mL ,V doit être en mL
Re, bon je suis content que tout aille a peu près bien, mis à part l'erreur de débutant à la 2.1....
Merci de ton courage 

Je fais peut être le reste tout a l'heure.
Voilà la suite: en rouge ce que j'ai fais:
2.3. Calculer l'avancement maximal de la réaction. Quel est le réactif limitant ?
D'après le tableau d'avancement, on à:
Voir tableau à la fin
xEq=n1/5=1,31.10-2/5=2,62.10-3mol
ou
xEq=n0/2=1,0.10-2/2=5,0.10-3mol
On prend le xEq le plus petit comme réactif limitant: il s'agit ici du C3H8O.
2.4. Exprimer l'avancement x de la réaction en fonction de n0Mn04- , c' et V'E.
n0Mn04-= c' * V'E.
Je n'en suis pas sur car j'ai l'impression d'avoir oublier la dilution dans l'exo......
3. Temps de demi-réaction.
3.1. Définir, à l'aide d'une phrase, le temps de demi-réaction t1/2.
Le temps de demi-réaction t1/2 est le temps pour lequel l'avancement de la réaction est la moitié de l'avancement final x(f).
3.2. La courbe représentant l'évolution de l'avancement de la réaction 1 en fonction du temps est donnée en annexe à rendre avec la copie.
Déterminer t1/2.
D'après la courbe, t1/2=2,5s
En rouge ce que j'ai fais:
l'équivalence concerne la réaction de dosage de MnO4- restant par Fe2+
Ma rectification était erronée.
les proportions stoechio de la réaction MnO4- sur Fe2+ était bien 1/5
à l'équivalence on a
n(MnO4-)/n(Fe2+)=1/5
n(MnO4-)=n(Fe2+)/5=c'*V'e/5
en utilisant le tableau d'avancement
à l'équivalence
n(MnO4-)-x=0 et n(Fe2+)-5x=0 c'VE=5x x=C'VE/5
n(MnO4-)=x=c'Ve/5
c'est agaçant de ne pas pouvoir corriger ce qu'on poste.
Tu ne tiens pas compte de ma réponse précédente pour le moment.Je me mélange les pieds entre les 2 réactions et les questions posées car je n'ai pas l'énoncé en face des yeux.je relis !
à la date t ,on dose 10 mL du mélange réactionnel
on trouve que n(MnO4- ) restant =c'Ve/5 ,cela dans 10 mL de prise d'essai.
d'après l'énoncé on peut estimer que le volume du mélange était de 100mL (101mL en réalité)
La qté de matière de MnO4- restant dans le mileu réactionnel est
n(MnO4-)(t)=10*n(MnO4-)prelevé=10*c'Ve/5=2*c'*Ve
si l'on considère l'équation 1
à la date t ,n(MnO4-)=no(MnO4-)-2x
donc no(MnO4-)-2x= 2*C'Ve
on en déduit x
sauf erreur ....
ne pas confondre l'avancement x de cette réaction avec celui du dosage (j'aurais dû le nommer y)
j'espère que tu t'y retrouves!



