Inscription / Connexion Nouveau Sujet
Dosage
Bonsoir, pourriez vous m'aider à finir cet exercice?  Le voici :
Le voici :
Le fer en excès peut réagir avec des phosphates et former un trouble si la dose de fer dans un vin est trop élevé : c'est la casse ferrique. Celle-ci devient probable au dessus de 10 à 15 mg/L. Donc, il faut pouvoir doser les ions fer dans le vin blanc pour éviter la casse ferrique. On réalise un dosage par étalonnage en utilisant une échelle de teintes et un spectrophotomètre(ici colorimètre).
L'élément Fe est présent en solution sous variantes formes: ions ferreux Fe2+et ions ferriques Fe3+ par exemple. Afin que tout le fer soit de la forme de Fe3+, on oxyde les ions Fe2+ à l'aide de l'eau oxygénée H2O2 en milieu acide.
Les ions ferriques Fe3+ sont par la suite révélés grâce à une réaction de complexation avec une solution de thycyanate de potassium (K+(aq)+SCN-(aq)) suivant la réaction Fe3+ +SCN- FeSCN2+. L'ion complexe prosuit a une couleur rouge. Donc on utilise l'absorbance de la solution et la comparer à celle de solutions étalon d'une échelle de teinte.
FeSCN2+. L'ion complexe prosuit a une couleur rouge. Donc on utilise l'absorbance de la solution et la comparer à celle de solutions étalon d'une échelle de teinte.
On dispose d'une solution mère d'ions Fe2+ à 100mg/L que l'on a obtenue en dissolvant du sel de Mohr (Fe(NH4)2(SO4)2,6H20) dans un litre d'eau.
On réalise à partir de cette solution mère des solutions filles par dilution.
Placer 10mL de chacune des solutions dans un tube à essai. Ajouter dans chacun : *1mL d'acide chlorhydrique à environ 5 mol/L, *1mL de thicyanate de potassium à 200 g/L, * une dizaine de gouttes d'eau oxygénée (à 10 volumes).
Réaliser d'autre part un tube identique où l'on a placé 10mL de vin et les réactifs ci-dessus.
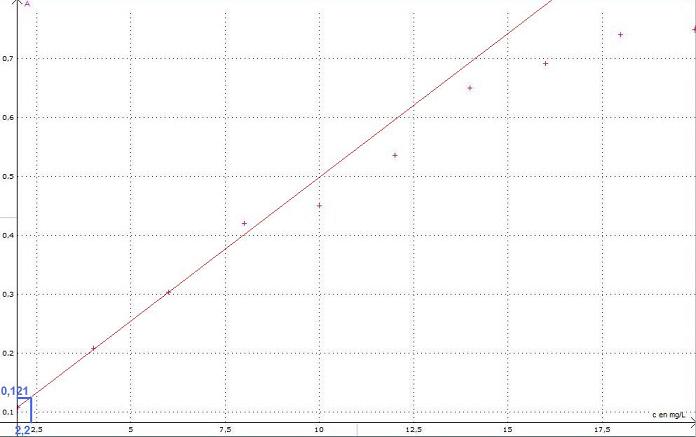
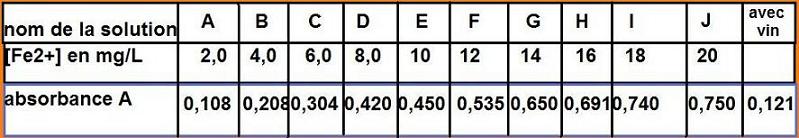
Réaliser la droite d'étalonnage A=f(c) du spectrophotomètre à 480nm (filtre de couleur verte)
Mesurer l'absorbance de la solution issue du vin blanc et utiliser le résultat obtenu pour déterminer la concentration en fer dans le vin blanc.
1)Rédiger le protocole chiffré de la préparation de la solution mère d'ions Fe2+
2)Rédiger le protocole détaillé de la préparation de la solution J.
3)Ecrire l'équation de la réaction d'oxydation des ions Fe2+par l'eau oxygénée.
4)Vérifier que la quantité d'acide chlorhydrique introduite dans chaque tube est suffisante.
5)Sachant q'une eau oxygénée à "x volumes" est une solution qui peut libérer x litres de dioxygène par dismutation (2H2O2  2H2O2 + O2) et qu'une goutte fait environ 0,05 mL, vérifier que la quantité d'eau oxygénée introduite dans chaque tube est suffisante.
2H2O2 + O2) et qu'une goutte fait environ 0,05 mL, vérifier que la quantité d'eau oxygénée introduite dans chaque tube est suffisante.
6)Vérifier que la dose d'ions thiocyanate introduite dans chaque tube est suffisante.
7)Donner les résultats des deux mesures de la concentration du fer dans le vin blanc en g/L et en mol/L. Risque t on la casse ferrique?
8)Comparer les deux mesures obtenues et commenter. Quelles sont les principales sources d'imprécision de chaque méthode?
____________________________________________________________________________
Est ce qu'il faut que la droite d'étalonnage passe par l'origine du repère? Pour moi ce n'est pas le cas..
Mon graphique à l'ordi n'est pas des meilleurs mais sur ma feuille de papier millimétré je trouve une concentration en ions ferreux de 2,2 mg/L qui correspond à l'absorbance de 0,121 du vin blanc. Ca me parait peu. Qu'en pensez vous?
1)Je pense qu'il faut connaitre la masse molaire de l'ion Fe2+ pour cette question mais quand c'est un ion comment faire? La masse molaire de Fe c'est 26,0 g/mol je crois mais que faire de ça?
2)On prélève 20mL de la solution J à l'aide d'une pipette jaugée de 20,0mL que l'on place dans une fiole jaugée de 100mL. On remplit jusqu'au trait de jauge avec de l'eau distillée et on rend la solution homogène. Est ce complet et juste? 
3)Pour les demi équations on a
Fe3+ e- = Fe2+
et
H2O2 = O2 + H+ + e- ou H2O2 + H+ + e- = H20
Mais comment choisir?
Les autres questions ensuite 
Merci
Bonjour Romane !
Ravi de te retrouver !
1) Ooooh ! Tu devrais savoir pourtant que la masse molaire d'un atome reste inchangée s'il s'agit d'un ion !!!!
2) C'est quoi la solution J ????
1) C'est bon pour le protocole ? Tu sais faire ?
2)
On prélève 20mL de la solution J à l'aide d'une pipette jaugée de 20,0mL que l'on place dans une fiole jaugée de 100mL. On remplit jusqu'au trait de jauge avec de l'eau distillée et on rend la solution homogène. Est ce complet et juste?
3)
Pour les demi équations on a
Fe3+ e- = Fe2+
et
H2O2 = O2 + H+ + e- ou H2O2 + H+ + e- = H20
Mais comment choisir?
Tu sais que tu as des ions Fe2+ en solution. Comme ils sont réducteurs du couple Fe3+/Fe2+ ils vont donc réagir avec l'oxydant (qui est H2O2) de l'autre couple !!! Donc quel couple choisis-tu ?


