Inscription / Connexion Nouveau Sujet
Dosage
Bonjour!!
J'ai un compte-rendu de TP à rendre pour lundi sur le dosage:dosage calorimétre d'une solution de permanganate de potassium par une solution de sel de Morh.
Vici le TP:
On dispose d'ne solution de sel de Morh de concentration Csdmm=0,0500moL/L
-A l'aide d'une pipette jaugée verser dans un erlenmeyer une prise d'essai E=10mL dee la solution de sel de Morh de conetration Csdm=0,0500mol/L.
-Ajouter de l'eau distillé en prenant soin de rine les parois de l'erlenmeyer.
-Ajouter à l'éprouvette 5mL d'acide sulfurique au 1/5 et 5mL d'acide phosphorique concentré.
-Placer la solution de permanganate de potassium dans la burette.
-Verser la solution de permanganate d potssium dans l'erlenmyer jusqu'aà l'équivalence du dosage.
-Faire 1 esai rapide puis réaiser 2 essais concordantts à la goutte près (0,05mL).
uestions:
Prremière partie:
Equation de dissolution et éqation de réaction.
Deuxième partie:
Schèma du dossage avec à droite de celui-ci ls volumes équivalants obtenus. On expliquera pr une phrase comment est repérée l'équivalence.
Troisième partie:
Formule littéral permettant de calculer la concentraton de la solution inconnue. Cette formule ser établi selon lemême modéle que le TP précédent: relation entre les quantités de mtière à l'équvalence, expresion des quantités de matère en fonction des concentrations et des volumes, puis formule permettant le calcul de la concentration.
Quatrième parte:
Résultats expérimentaux et calculs avc tableaux de résultats. La concentration de la solution sera exprmée avec son incrtitude absolue. (Précission du dosage 1%)
Réponses:
Première partie:
Equations de dissolutions: FESO4,(NH4)2SO4,6H2O,MnO4----->Fe2++2NH4-+6H2O+MnO4-
Equation de réaction:j'ai pas compris.
L'équivalece est repére dès que la solution ce colore en rose.
Deuxième partie:
Schéma ok est-ce-quejuste il fut dessiner la burette? Volumes:Essai=10,10mL Csdm=0,00500mol/Lprendre 10mL acide sulfurique=5mL acide phosphorique=5mL
Troisième partie:
Je sais pas comment faire.
Quatrième partie:
Je vois pas ce qu'il faut mettre dans résultat expérimentaux calculs pourquoi il y a un s alors que je doit faire q'un calcul? Je comrends pas l'insetitude.
Est-ce-que quelqu'un aurait la gentillesse de me dire si ce que ja fais est bon et de m'expliquer le reste?
Merci
Edit Coll : police des caractères
Salut mel 
Partie 1 : on te demande l'équation de dissolution du sel de Morh avec l'eau. Il ne doit pas y avoir du MnO4- qui est dans la burette...
Equation de la réaction : on te donne les couples en jeu ou non ?
Partie 2 : Schéma du dosage (à faire).
Définition de l'équivalence ?
Partie 3 et 4 : essaie de refaire la 1 et 2. Ensuite, on verra pour le reste  .
.
_____________________________________________________
Remarque : on ne te donne pas la concentration de la solution de permanganate de potassium ???
Partie 1: l'équation d dissolution est la même que clle que j'ai écrite mais sans MnO4-.
Justement on ne me donne pas les couples en jeu.
Partie 2: Si j'ai bien compris je dois dessinner la burett?
L'équivalence est repérée par un changementde couleur. Mais je l'avais déja marqué. L'équivalece est repére dès que la solution ce colore en rose.
1. L'équation de dissolution du sel de Morh dans l'eau est
(NH4)2SO4,FeSO4, 6H2O = 2 NH4+ + 2SO42- + Fe2+ + 6 H2O
2. Schéma du dosage :
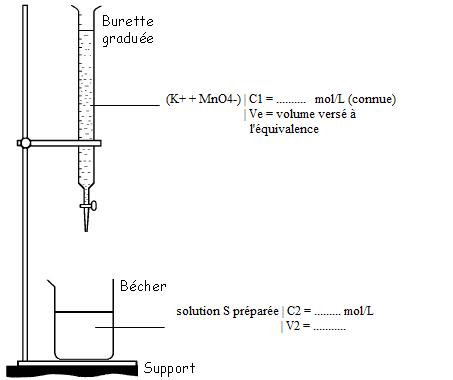
L'équivalence est atteinte quand les réactifs de la réaction du dosage ont été introduits dans des proportions stoechiométriques. Ici on la repère lorsque la solution prend une couleur violette.
3. Equation de la réaction du dosage :
Les couples en jeu sont Fe3+/Fe2+ et MnO4-/Mn2+.
Fe2+ = Fe3+ + e- x5
MnO4- + 8H+ + 5e- = Mn2+ + 4H2O
______________________________________________________________________________
Fe2+ +
MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O
(à vérifier).
Faire un tableau d'avancement si nécessaire.
A l'équivalence,
<=> C2.V2/5 = C1.Ve
<=> ....
Merci beaucoup beaucoup!!!!
Juste pour la partie 4ourquoi il y a un à calculs alors que je n'ai qu'un calcul à faire et il faut mettre quoi dans le tableaux de résultats et j comprends pas 'est quoi l'insertitude.
Juste vérifier si je n'ai pas fait d'erreur.
L'incertitude est de comparer une valeur théorique à une valeur expérimentale.
Merci mai pour la partie 4 pourquoi il y a un s à calculs alors que je n'ai qu'un calcul à faire et il faut mettre quoi dans le tableaux de résultats.
Merci il est trop beau ton dessin.
Dans le première envoi je t'ai donné tout l'énoncé. Je n'ai pas plus.
Pour la partie 1 il y a une équation de dissolution celle pour le potassium:KMnO4---->K+ + MnO4-
Merci mais pour la partie 4 pourquoi il y a un s à calculs alors que je n'ai qu'un calcul à faire et il faut mettre quoi dans le tableaux de résultats.
Dans le schéma: C1=0,0500mol/L
C2=inconnue à calculer
V2=10,10mL
Attention, c'est un TP à préparer. Tu ne connais pas encore le volume équivalent. A ce jour, tu peux juste faire le calcul littéral.
Merci mais pour la partie 4 pourquoi il y a un s à calculs alors que je n'ai qu'un calcul à faire et il faut mettre quoi dans le tableaux de résultats.
C'est vrai, c'est un peu bizarre ...
Non mais je l'ai déja fait le TP dans le première envoi je t'ai dis que le volume à l'équivalec était de 10,10mL, enfin c'est le volume que j'ai mesurée au monment où le bécher à changé de couleur.
Pour la partie 1 il y a une autre équation de dissolution celle pour le potassium:KMnO4---->K+ + MnO4-
Merci mais pour la partie 4 pourquoi il y a un s à calculs alors que je n'ai qu'un calcul à faire et il faut mettre quoi dans le tableaux de résultats.
Dans le schéma: C1=0,0500mol/L
C2=inconnue à calculer
V2=10,10mL
10, 10mL c'est égale à Ve ou à V2 ans ton schéma et je sais aussi que le volume de prisse d'essai E=10mL.
Déjà, l'équation de dissolution est évidente.
Ensuite Ve = 10,10 mL = volume versé à l'équivalence.
C1 = 0,0500 mol/L
V2 = volume de la solution préparée = je ne sais pas si on doit tenir compte du volume des 2 acides ou non.
Si on compte le volume d'acide, V2 = 20mL. Sinon, V2 = 10 mL.
Comment j fais pour savoir si il faut prendre en compte les 2 acdes où pas? Pour la partie 4 pourquoi il y a un "s" à calculs alors que je n'ai qu'un calcul à faire et il faut mettre quoi dans le tableaux de résultats.
On s'en moque du "s". L'essentiel est de bien détailler le résultat final à savoir C2.
Pour ma part, je compterais les volumes des acides car on ne peux pas les négliger.
Donc V2 = 10 + 5 + 5 = 20 mL
Ve = 10,1 mL
C1 = concentration de la solution de permanganate.
Tu peux donc calculer C2  .
.
Courage !
Merci baucop mais pour les résultats expérimentaux et calculs avec tableaux de résultats, il y a qu'un seul réultat expérimentale et il faut mettre quoi dans le tableaux.
Sincèrement, je voudrais plus t'aider mais là, je ne vois pas quel(s) calcul(s) ils demandent à part C2. C'est un dosage M.... !
C'est à rendre pour quand ?
Merci beaucoup de m'aider. C'est quoi un dosage M...? A t'on avis il faut mettre quoi dans le tableau? C'est pour lundi mais j'aimerai bien en avoir fini aujourd'hui. C'est qui Amandine?
Salut
Est ce que tu peux m'aider sur la partie 4 du TP. Pour les résultats expérimentaux et calculs avec tableaux de résultats pour il y a un "s" à calculs alors qu'il y a qu'un seul réultat expérimentale et il faut mettre quoi dans le tableaux.
Dans le tableau, il faut pas mettre les résultats des différents essais puis le calcul de chaque concentraion inconnue?
Est ce que tu peux me dire si dans mes volumes ue je vais te donner mes résutats sont justes par rapport à l'incertitude arce que en classe je n'ai noté qu'un sul réulta de la burette et j sais que le 2éme est dans c'est alentour mais je sais pas si il peut-êttre juste. Volume:10,10mL 10,08mL et 10,10mL et je comprends pas quand il faut refaire où pas l'expérience par rapport au volume que je trouve avec la burette.
Mel75 pas de panique c'est un dosage !
Il faut appliquer la méthode classique que tu as très certainement vue en cours.
Moi, je ne fais pas de tableau d'avancement, mais peut-être qu'en classe, ta (ton) prof en utilise un.
Formule littérale permettant de calculer la concentraton de la solution inconnue. Cette formule est établie selon le même modèle que le TP précédent: relation entre les quantités de matière à l'équivalence, expression des quantités de matière en fonction des concentrations et des volumes, puis formule permettant le calcul de la concentration
C'est dans l'énoncé, les voici TES calculS.

Oui mais pour les différents calculs il s'agit de chaque volume parceque j'ai fait 3 fois le dosages pour vérifier. Mes calculs ne sont pas dans l'énoncé puisque dans l'"noncé il faut juste mettrela formule litéral.
Est ce que tu peux me dire si dans mes volumes ue je vais te donner mes résutats sont justes par rapport à l'incertitude arce que en classe je n'ai noté qu'un sul réulta de la burette et j sais que le 2éme est dans c'est alentour mais je sais pas si il peut-êttre juste. Volume:10,10mL 10,08mL et 10,10mL et je comprends pas quand il faut refaire où pas l'expérience par rapport au volume que je trouve avec la burette.Alors est-ce-que tu as demandé à amandine pour V2?
Tu utilise Ve = 10,1 c'est largement suffisant.
Tu connais le calcul littéral de C2.
Pour ce qui est de V2, j'attends toujours la réponse de Shadowmiko...
Est-ce-que tu peux m'expliquer cmment une fos que j'ai fas le calcul je peux l'exprimer avec son incerttude et est ce que tu peux me dire sur quel site tu a trouvé le même dosage?
Merci mais je voudrais savoir sur quel site tu a trouvé le même dosage parce que j'ai cherché sur interet mais je ne trouve pas?
Je suispas trop d'accord pour V2 parce que ça orrespond au volume dans le bécher or dans le bécher il y a du sel e Mohr plus de l'acide sulfurique plus de acide phosphorique.
Salut
En fait je viens d'avoir ma note et j'ai eu 6,5/12 mais je comprends pas la correction de la quatriéme partie Il me dit que n(Fe2+dans V2/5=n(MnO4-dans Ve/1 c'est juste mais ce qu j'ai écris aprés c'est faut
Dans la correction on a écrit nMnO4-=nKMnO4=CMnO4*Veq/1000 déja je comprends pa d'où il sort le 1000 j crois que c'est parc qu'on la dilué 1000 fois
nFe2+=nsel e morh=CSdM*VE/1000
CKMnO4=CSdM*VE/5*Veq
VE=V2
Veq=Ve
CMnO4=C2
CSdM=C1
alors je comprends pas je pense que la correction est fausse
Peux-tu m'expliquer ce que j'aurais faut et la correction?
Dans la correction on a écrit nMnO4-=nKMnO4=CMnO4*Veq/1000 déja je comprends pa d'où il sort le 1000 j crois que c'est parc qu'on la dilué 1000 fois
Tu ne me l'avais pas dit ça !
CKMnO4=CSdM*VE/5*Veq
C'est ce que je t'avais expliqué auparavant.
________________________________________________
La correction me semble correcte mais il faut la prochaine fois que tu donne le protocole de l'expérience ENTIEREMENT (une dilution par exemple, ...).
Sinon, il fallait compter le volume d'acide ou non ?
En fait dans le schéma que tu m'as donnée la concentration 1 était celle de KMnO4 donc inconnue et la concentration 2 était celle du sel de Mohr donc connue=0.500 mol/L et toi tu m'as dit l'inverse c'est pour ça que je me suis trompée dans la formule littéral.
c'est pour ça que je me suis trompée dans la formule littéral.
L'application numérique tu veux dire. J'ai surtout fait le calcul littéral. C'est tout de même aberrant de chercher la concentration de la solution dans la burette...
L'essentiel est d'avoir compris la démarche
 .
.
Je te souhaite une bonne fin de semaine.
oui mais en fait ce qui était connue était ce que'on avait mis dans le bécher est non dans la burette.

 5,0.10-5 mol/L
5,0.10-5 mol/L

