Inscription / Connexion Nouveau Sujet
dosage
Bonsoir,
On réalise le dosage des ions fer(II) Fe2+ par les ions permanganates MnO4- de concentration molaire c1=2*10^-2 mol/L-1
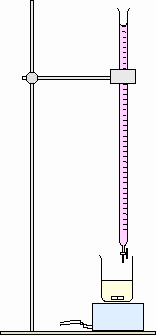
1. Faire un schéma annoté du dispositif de dosage
J'ai un gros trou de mémoire je ne sais plus comment les faire :s
pouvez vous m'aider sVp
Il est trop beau votre schéma
de plus dans l'énoncé il est écrit :
Pour cela, on prélève 20 mL d'une solution de sulfate de fer que l'on introduit dans un bécher
La solution acidifiée de permanganate de potassium est introduite dans une burette. Il faut en verser 14.4mL pour atteindre l'équivalence
donc pour la légende je pense que dans le bécher le sulfate de fer mis à l'aide d'une pipette jaugée de 20mL et d'une propipette et dans la burette mettre le permanganate de potassium?
qu'elle est la différence entre le sulfate de fer et les ions ferII??
Tu doses les ions fer (II) par le permanganate: l'espèce titrante se trouve toujours dans la burette et l'espèce titrée dans le bécher...
Ici la titrante c'est le permanganate de potassium acidifié (K+ + MnO4-)aq, et l'espèce titrée c'est le sulfate de fer II (Fe2+ + SO42-)aq.
qu'elle est la différence entre le sulfate de fer et les ions ferII??
 Regarde la formule
Regarde la formule
ensuite il me demande d'écrire les demi-équations électroniques relatives aux couples Fe3+/Fe2+ et MnO4-/Mn2+
En déduire léquation de la réaction d'oxydoréduction ayant lieu lors de ce dosage.
Fe3+ + 1 électron= Fe2+ *5
5électrons +MnO4-+8H+=Mn2++4H2O
5Fe2++MnO4-+8H+-->5Fe3+ +Mn2+ 4H2O
définir l'équivalence:
Al'équivalence les réactifs sont totalement consommé, ils ont été introduit dans les proportions stoechiométrique.
L"='équivalence correspond au changement de réactif limitant NON??
encore une petite question svp : il me demande de choisir dans la liste qui suit les qualificatis qui caractérisent une réaction servant de support à un dosage. la réaction doit être: totale, limitée, rapide, lente
Je pense que la réction doit-être totale et rapide non 
Re !
!
Ok pour ton équation
Al'équivalence les réactifs sont totalement consommé, ils ont été introduit dans les proportions stoechiométrique.
L"='équivalence correspond au changement de réactif limitant NON??
Effectivement elle doit être totale et rapide

shadowmiko j'ai besoin d'aide sur mon topic (melange) si te plait peut tu jeter une coup d'oeil merci d'avance
bonsoir,
merci pour l'aide apporté mais je voulais encore vous demander quelque chose sur des points que je ne suis pas sur:
Etablir un tableau descriptif descriptif du système chimique à l'équivalence, En déduire une relation entre la quantité d'ions MnO4-versés et la quantitédes ions Fe2+ initialement présents.
Le tableau c'est fait pas de problème
A l'équivalence les réactifs sont totalement consommés:
nf(MnO4-)=0 et nf(Fe2+)=0
ni(MnO4-)-xe=0 ni(Fe2+)-5xe=0
xe=[MnO4-]*Ve ni(Fe2+)=5*[MnO4-]*Ve
--Quel est le réactif limitant -avant l'équivalence? c'est le réactif titrant ( permanganate de potassium)
- après l'équivalence? c'est le réactif titré (le sulfate de fer)
--Quel changement de teinte observe t-on à l'équivalence?
A l'équivalence, la solution change de couleur , on passe d'une solution jauge à rose, viollette
--Déterminer la quantité des ions Fe2+ initialement présent
nf(Fe2+)=0
ni(Fe2+)-5xe=0
ni(Fe2+)=5*[MnO4-]*Ve
=5*2*10^-2*14.4*10^-4
=1.44*10^-4 mol
--Sachant que le volume de la solution d'ions Fe2+ est égal à 100 ml et que la formule chimique du sulfate de fer II hydraté est FeSO4, 7H2O, déterminer:
a- la concentration c de la solutrion d'ions Fe2+
b- la masse m de sulfate de fer hydraté nécessaire à la préparation de cette solution .
Décrire le protocole expérimental de cette préparation
[Fe2+]=ni(Fe2+)*V
=1.44*10^-4*0.1
=1.44*10^-3 mol.L-1
c'est bon??
b)m(FeSO4, 7H2O)= n(Fe2+)*M(FeSO4, 7H2O)
=1.44*10^-3*182
=0.262g
Ca me parait très petit, non??
Par contre le protocole je ne sais pas 
Merci d'avance
Salut !
!
Moi ça me paraît bon
Pour le protocole c'est celui d'une dissolution.
Tu pèses ta masse, tu l'introduis dans ta fiole, tu remplis jusqu'au trait de jauge en terminant au compte-goutte; tu bouches, tu homogénéises ta solution