Inscription / Connexion Nouveau Sujet
DM TS partie Chimie
Bonjour j'ai ce dm a faire pour la rentrée et ai quelques difficultés pouvez vous m aider.
On prepare 200 mL d une solution S en melangeant a la date t=0 un volume V1=100.0 mL d une solution de iodure de potassium de concentration C1=0.40 mol.L-1 et un volume V2=100.0 mL d une solution de peroxodisulfate de sodium de concentration C2=0.063 mol.L-1. La solution S est maintenut a temperature constante et se colore en raison de la formation de diiode par la recation d equation bilan:
S2O8²- + 2I- = 2SO4²- +I2
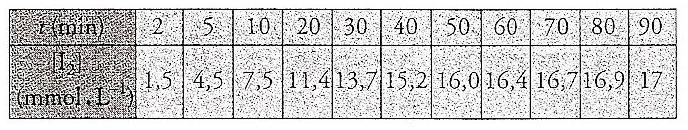
on peut suivre l evolution de la reaction en determinant par un dosage la concentration de diiode formé. A differents instants, on effectue des prelevements reguliers et chaque prise est dilué rapidement dans de l eau glacée.Les mesures réalisées sont consignées dans le tableau ci dessous
1-preciser succesivement le protocol experimental et le materiel utilisé
2-pourquoi a t on maintenu la solution S a temperature constante? pourquoi avoir dilué chaque prelevement dans de l eau glacée?
3-les couples redox sont: I2/I- et S4O6²-/S2O3²-
ecrire les demi equations d oxydoreductions et etablir l equation de la reaction de dosage. comment repere t on l equivalence de ce dosage?
4-tracer la courbe [I2]=f(t)
5-definir et determiner la vitesse volumique de reaction aux dates t=0 min t1=10min t2=20min.comment interpreter ces variations
6-a)calculer les concentrations initiales des ions iodure et peroxodisulfate dans la solution S et verifier qu au dela de 90 min la reaction est pratiquement terminée
b)en deduire graphiquement le temps de demi reaction t1/2
Je suis tres mauvais en chimie et ne sais pas faire grand chose mais je pense que j'ai bon pour ca au moins
2-temperature constante pour que la reaction aille vite et sans changer de vitesse
l eau glacée stoppe la reaction
3-I2+2e-=2I-
S4O6²-+2e-=2S2O3²-
mais je n'ai pas la suite
pouvez vous m aider
Bon apres quelque recherche j'ai dévelloppé cette exercice pouvez vous m aidez voici mon resultat:
1)Dans un becher, on verse 100mL d une solution de iodure de potassium de concentration C1=0.40 mol.L-1 et dans un autre becher on verse 100mL 100.0 mL d une solution de peroxodisulfate de sodium de concentration C2=0.063 mol.L-1. On melange ces 2 solutions dans un becher posé sur un chauffage a temperature constante au temps t=0.On observe alors la colorotion de cette solution S au cours du temps, puis a differents instant t on preleve a l aide d une pipette cette solution que l'on melange avec de l eau glacée pour connaitre la concentration de diiode formée.
2)La temperature constante permet a la reaction d aller plus vite mais toujours a la meme vitesse pour ne pas precipité la reaction.L'eau glacée quand a elle stoppe la reaction.
3)I2+2e-=2I-
2S2O3²-=S4O6²-+2e-
I2+2S2O3²-=2I-+S406²-
L'equivalence de ce dosage se repere lorsque il y a changement de couleur
4)Faire un graphe d apres le tableau ce sera une courbe croissante
5)6) Celle la je n'y arrive pas je ne vois pas comment trouver les concentrations ni comment verifier a t=90 et encore moins trouver la vitesse a chaque temps pouvez vous m aider svp
2)la vitesse de réaction dépend de la température.
Si l'on veut étudier la variation de la vitesse en fonction du temps il faut maintenir la température constante
3)disparition de la couleur bleue
5)tu as tracé [I2]=f(t)
tu traces les tangentes à la courbe aux points d'abscisses t=10min
et t=20 min
la pente de ces tangentes est égale à d(I2]/dt
il faut maintenant relier ces résultats à la vitesse volumique
v=1/V *dx/dt x étant l'avancement
d'après l'équation de réaction(dans l'énoncé),x=n(I2)t
donc v=(1/V)*d(n(I2))/dt =d[I2]/dt puisque n(I2)/V=[I2]
la vitesse volumique aux dates t1 et t2 est donc ,dans ce cas ,égale à la pente des tangentes à la courbe aux points d'abscisses t1 et t2
au 6 a)
vérifie la concentration de peroxodisulfate dans l'énoncé car il y a un problème!
C2= 0.036 mol.L-1 j'ai tapé trop vite
Donc pour la 5 a t=0 la vitesse est nul ?
et d[I2] c'est egal a l endroit ou se coupe les tangentes c'est ca ?
C2=0,036 mol/L: j'aime mieux !
dans 100mL (prélèvement)
n(peroxo)=0,036*0,1
dans le mélange (V=200mL)
[I2]i=n(I2)/0,2=0,018mol/L =18 mmol/L
le peroxodisulfate est le facteur limitant.
xmax=n(peroxo)i
n(I2]max=xmax
donc [I2]tend vers 18 mol/L au bout d'un temps infini (à 90 min on est à 17 mmol/L)
à t=0 v n'est pas nulle mais au contraire max.
Il faut tracer la tangente à l'origine et calculer sa pente.
et d[I2] c'est egal a l endroit ou se coupe les tangentes c'est ca ?
je ne comprends pas ce que tu veux dire
d[I2]/dt est égal à la pente des tangentes à la courbe aux points d'abscisses
t=0 t=10 t=20min.
on doit constater que la pente diminue ,donc que la vitesse de réaction diminue


