Inscription / Connexion Nouveau Sujet
DM de physique
Bonjour, j'ai un DM de physique à faire, mais je n'y arrive pas... Si vous pouviez m'aider. Merci ! 
Voici le sujet :
Le pentane est un solvant utilisé en chimie organique. Sa formule brute est C5H12. En donner tous les isomères possibles (il y en a 3)(ne donnez que la formule développée).
Aide : Pour déterminer les isomères d'une molécule de formule brute non donnée, étbalir une première formule de Lewis, puis modifier l'agencement des atomes de cette molécule jusqu'à obtenir tous les enchainement possibles.
Bonjour, (re  )
)
Commence par essayer de trouver une formule de lewis pour l'instant, avec toutes les étapes:
- structure électronique des atomes
- nombre d'électrons sur les couches externes
- nombre de doublets
- et enfin répartition des doublets en respectant le duet et l'octet
Re 
J'arrive à faire toutes les étapes, sauf la dernière... Il faut bien trouver le nombre de doublets liants et non liants ?
Si c'est la cas, je ne sais pas comment faire.
hum, oui, enfin je sais pas, on peut avoir plusieurs manières de procéder. Combien as-tu trouvé de doublets?
OK, donc ce sont les doublets liants ET non liants.
Pour les formules de Lewis, il faut essayer, regarder si ça marche, puis ajuster.
Quelques conseils: les H sont forcément reliés à un seul atome, car ils doivent respecter la règle du duet, donc il faut les mettre "aux bouts" de la molécule.
Commence par faire un essai en ne mettant que des liaisons simples par exemple, et vérifie que tous les atomes vérifient l'octet (pour le carbone), càd que tous les atomes de carbone sont entourés par 4 doublets (8 e-) et le duet pour l'hydrogène.
(tu peux essayer de dessiner la molécule avec des - et des | mais c'est vrai que c'est pas très pratique sur un forum)
D'accord. Alors la première représentation de Lewis que j'ai trouvé est :
H-H-H-H-H
! ! ! ! !
H-C-C-C-C-C-H
! ! ! ! !
H-H-H-H-H
Très bien!
En fait, la vraie formule développée du pentane, c'est celle là.
Maintenant, essaie de bouger les liaisons (doubles liaisons, cycles?), les atomes, pour voir ce que ça donne.
Je cherche en même temps que toi 
en fait ça ne marchera jamais les doubles liaisons ou les cycles, oublie ce que j'ai dit 
essaie plutôt de bouger les atomes de carbone
Mais je ne comprends pas quelle autre représentation peut-on faire, sachant que l'hydrogène n'admet qu'une seule liaison ... :/ ?
Essaie de relier un carbone à trois autres carbones par exemple, ta molécule n'est pas forcément toute linéaire. Le truc c'est de ne jamais mettre d'hydrogène en plein milieu, c'est tout
 Je crois que si tu tournes la tête vers la gauche, tu verras exactement la même molécule qu'avant!
Je crois que si tu tournes la tête vers la gauche, tu verras exactement la même molécule qu'avant!
bon allez, je taide:
H
|
H H-C-H H H
| | | |
H- C - C - C - C - H
| | | |
H H H H
Ah mais on a le droit de mettre des hydrogènes collés sans doublets liants ? Je ne savais pas...
Merci !
en fait ils ne sont pas vraiment "collés"... ils sont juste pas très loin 
Et puis c'est mal dessiné, sur ta feuille, essaie de les espacer un peu plus pour ne pas qu'ils se touchent.
Par ailleurs, "dans la vraie vie", les atomes d'hydrogène sont beaucoup plus petits que les atomes de carbone, donc pas de souci de ce côté là non plus, ils ne se toucheront pas!
Pour la troisième, essaie de rajouter encore un carbone lié à notre deuxième carbone en partant de la gauche
Euuh mais j'ai le droit de mettre un hydrogène sans aucune liaison et séparé des autres ?
Et pour le troisième, je ne comprends pa ce que vous voulez dire.
ah, non, pas séparé des autres complètement! Il faut quand même qu'il soit relié à un carbone quelque part! C'est vrai que mon dessin n'est pas hyper clair... essaie de le refaire sur une feuille, tu verras qu'ils sont tous reliés à un carbone. (le premier carbone a bien un H relié en haut, c'est juste qu'il est décalé si c'est celui là qui te pose problème)
Je crois qu'il est temps que j'aille me coucher, mes phrases sont de plus en plus incompréhensibles... 
Je voulais dire, au début on avait mis tous les carbones alignés, puis j'ai décidé de prendre un des carbones et de "l'attacher" sur le deuxième carbone, maintenant, essaie de prendre un autre carbone du bout et de le mettre à la place de l'hydrogène restant sur le deuxième carbone.
Bon j'avoue, je sais pas si c'est plus clair dit comme ça... mais c'est pas vraiment facile à expliquer avec des mots, sans schémas et derière un ordi...
J'espère que t'auras quand même réussi à comprendre mon charabia... 
Bonjour, alors déjà je n'ai toujours pas compris pourquoi de chaque coté du premier carbone, il y a 2 hydrgènes non liés..
Ensuite, j'ai du mal à comprendre votre raisonnemenent pour faire la dernière représentation de Lewis.
Je pars au ski cette semaine, je serais rentrée jeudi matin. Je vais essayer de continuer à faire ce DM, qui contient encore 3 autres exercices...
A jeudi ! 
Il n'y a pas deux hydrogènes non liés... c'est juste pas très clair sur le dessin;
Deux dessins un peu meilleurs, donc un en 3D pour que tu voies mieux:
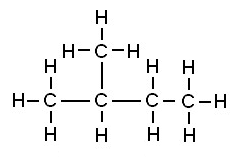
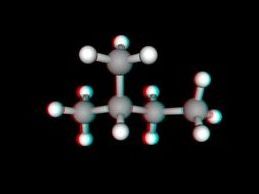
Ah merci, je comprends mieux 
J'ai cherché pendant toute une matinée la dernière solution, mais j'ai arrêté parce que je n'ai vraiment pas trouvé. Pouriez-vous me donner juste des pistes pour que je trouve ?
Essaie de mettre un carbone central entouré des 4 autres carbones (à gauche, à droite, en haut, en bas)
Ca y est ! J'ai enfin trouvé ! 
Merci beaucoup pour votre aide !! J'ai presque fini mon DM grâce à vous ! 
J'aimerais vous poser une dernière petite question :
Je ne comprends pas cette question :
La molcécule PF3(trifluorure de phosphore) est-elle tétraédrique, pyarmidale ou coudée ? Justifiez.
Données : P(Z=15) et F(Z=9).
Pourais-tu aller dans un nouveau topic s'il te plait Ameli01 parce que Thetys était occupé avec moi.
Merci!
Charlott3: avez-vous vu la représentation de Cram?
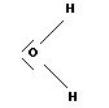
généralement, une molécule dont l'atome central est lié à deux autres atomes et deux doublets non liants est coudée (comme la molécule d'eau)
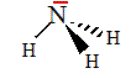
Une molécule dont l'atome central est lié à trois autres atomes et un doublet non liant forme une pyramide (comme l'ammoniac NH3)
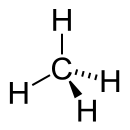
Une molécule dont l'atome central est lié à quatre autres atomes par des doublets liants forme un tétraèdre (comme le méthane CH4).
N'as tu pas des exemples dans ton cours?
Cela s'explique par le fait que les doublets liants et non liants qui entourent un atome central, de charge négative, se repoussent.
Commence par écrire la formule de Lewis de ta molécule, et regarde à quelle catégorie elle appartient
En tout cas, si vous n'avez pas vu le cours, je ne vois pas trop l'intérêt de vous poser cette question...
Si j'ai regarder mon cours !
Mais il n'y a pas marqué ce que voulait dire tétraédrique, pyarmidale ou coudée...
ah, ok.
Et bien, si tu regardes les molécules représentées, la première, l'eau est coudée (elle forme un coude... imparable  )
)
La deuxième, l'ammoniac est pyramidale
La troisième, le mathane est tétraèdrique
Parce qu'il n'y a rien à comprendre...
Ce sont juste des définitions! sur les représentations des 3 molécules que j'ai postées, la forme de la première s'appelle une géométrie coudée, la forme de la deuxième s'appelle une géométrie pyramidale, et la forme de la troisième s'appelle une géométrie tétraèdrique...
Après par rapport à ta question, et bien tu fais la formule de Lewis de PF3, et tu regardes à quelle géométrie ça correspond par rapport à ce que j'ai écrit au début de mon message de 10:50



