Inscription / Connexion Nouveau Sujet
détermination du pka du couple acide ethanoique et l'ion ethanoa
bonjour j'ai un exercice a rendre pour mardi 19/01/10
mais je bloque dessus pouver vous m'aider je vous en remercie d'avance voici l'exercice
afin de determiner le pka du couple acide ethanoique/ion ethanoate on mesue le ph de solutions contenent ces deux especes chimisues. on donne:
une solution s1 d'ethanoate de sodium de concentration en soluté apporté c1 = 1.0*10-1 mol/l
une soution s2 d'acide ethanoique de concentration en soluté apporté c2 = 1.0*10-1 mol/l
on prepare successivement les melanes figurant dans le tableau ci dessous puis on mesure leurs ph
melange m1 m2 m3 m4 m5 m6 m7 m8 m9
volume v1 de s1 4 10 20 30 40 40 40 40 40
volume v2 de s2 40 40 40 40 40 30 20 10 4
ph 3.6 4 4.3 4.5 4.6 4.7 4.9 5.2 5.6
v1/v2
log v1/v2
1. y'a t-il un transformaton susceptible de se produire dans le melange?si oui, laquelle?cette tansformation modifierait-elle les concentrations des especes presentes?
2.montrer que le pport des concentrations effectives des deux especes conjuguées est tel qu:
[ch3-coo-]éq/[ch3-cooh]éq = v1/v2.
on admet que ni l'acide ni la base ne réagissent avec l'eau
3a.écrire l'equation chimique de la reaction entra l'acide ethanoiqe et l'eau
b.donner la relation entre les concentrations l'equilibre et la constante d'equilibre associé a cette equation
c.en deduire une formule liant le ph le pka et le rapport [ch3-coo-]éq/[ch3-cooh]éq
4a. tracer la courbe representant les variations du ph en fonction de log[ch3-coo-]/[ch3-cooh]
b. a l'aide de la courbe et de la reponse a la question 3 donner une valeur approche du pka du couple.
MES REPONSES SONT EN MAJUSCULES/
3A.CH3-COOH+ H2O = CH3-COO- + H3O+
C. AVEC PH = -LOG[H3O+] ET PKA =-LOG KA ON A
PH = PKA + LOG [CH3-COO-]/[CH3-COOH]
VOILA MERCI DE TOUS LES RENSEIGNEMENT QUE VOUS POURRER ME FOURNIR
MERCI D4AVANCE
1)oui et la transformation serait
CH_3 COO[sup][/sup]- + CH_3 COOH = CH_3 COOH + CH_3 COO^ - $
2)il apparaît autant de $CH_3 COO^ - $ qu'il en disparaît et idem pour $CH_3COOH$
Les quantités de matière sont donc à l'équilibre les mêmes que dans l'état initial.
soient $\left[ {CH_3 COO^ - } \right] = c_1 v_1 {\rm{ et }}\left[ {CH_3 COOH} \right] = c_2 v_2 {\rm{ }}$
la relation d'Henderson-Hasselbalch
à savoir ${\rm{pH = pKa + log}}\frac{{\left[ {CH_3 COO^ - } \right]}}{{\left[ {CH_3 COOH} \right]}}$
s'écrit alors: ${\rm{pH = pKa + log}}\frac{{c_1 v_1 }}{{c_2 v_2 }} = {\rm{pKa + log}}\frac{{v_1 }}{{v_2 }}$ puisque c1=c2
4
Bonjour Bella
1) Oui et la transformation serait compte tenu des espèces en présence:
2) Il apparaît autant de qu'il en disparaît et idem pour
Les quantités de matière sont donc à l'équilibre les mêmes que dans l'état initial.
soient
3a)
3b)
3c)
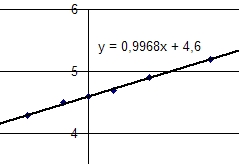
4a)Voir la représentation graphique ci dessous pH=f(log(v1/v2))
On obtient une droite d'équation pH#4,6+log(v1/v2)
b) Par identification, il vient pKa=4,6.
A bientôt et bonne terminale S