Inscription / Connexion Nouveau Sujet
degré dun vinaigre (titrage)
bonjour j'aurai voulu savoir quelques conseil sur un exercice a faire en chimie sur le titrage.
voici l'exercice:
1.L'acide acétique (ou éthanoïque) est un acide de formule CH3-CO2H. un vinaigre est une solution aqueuse d'acide acétique.La base conjuguée de l'acide acétique est l'ion ethanoate.
Quelle est sa formule? j'ai rien mis pas bien compris que mettre?
2.Pour déterminer la concentration molaire en acide acétique dans le vinaigre, on réalise les opérations suivantes:
_On prélève, à l'aide d'une pipette jaugée, 10 mL de vinaigre que l'on verse dans une fiole jaugée de 100 mL. On complète au trait de jauge avec l'eau distillé et on agite pour homogenéiser. On note la solution S
_On verse dans un bécher 250 mL d'eau distillé et on n y ajoute Vs=10.0mL de la solution S
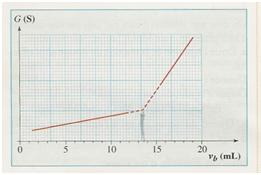
_On dose ce volume par titrage, on suit pour cela l'évolution de la conductance G de la solution contenue dans le becher quand on y ajoute une solution d'hydroxyde de sodium de concentration molaire cB=010.mol. on a ensuite un graphique représenté que vous trouverez sur
https://www.ilephysique.net/img/forum_img/0229/forum_229042_1.jpg
a.On note c et cs les concentrations molaire en acide acétique du vinaigre et de la solution S. Ecrire la relation entre c et cs
=> j'ai mis c.v=cs.vs dc 10c=100cs soit c=10cs
b. Ecrire l'equation de la réaction entre l'acide acétique et les ion HO-(aq)
=> j'ai mis CH3COOH+HO=>CH3COO-+H2O
c.Dresser le tableau d'evolution du titrage de l'équivalence on note Xe la valeur de Xmax à l'équivalence
j'ai mis
CH3COOH + HO- ---> CH3COO- +H2O
csvs cb.vb 0 0
csvs-x cb.vb-x 0 0
d.calculer cs, en déduire c
je n'ai pas rien mis que mettre?
3. Le degrés d'un vinaigre est égal a la masse,en gramme,d'acide acétique pur contenu dans 100g de vinaigre
a. Calculer la quantité de matière d'acide acétique contenue dans un litre de vinaigre, puis celle contenue dans 100mL de vinaigre
Ici je ne comprend plus rien
b En déduire le degrés du vinaigre
Données : masse molaire de l'acide acétique, M=60g.mol
masse volumique du vinaigre étudié p=1.00g.mL
pourriez-vous m'aider sur les questions où je suis bloqué et me confirmer si mes réponse sont juste merci d'avance a tous ce qui m'aideront
bonjour,
1)on demande la formule de la base conjuguée de CH3COOH c'est à dire CH3COO-
2a)b) OK
dans le tableau ,en cours de réaction on a bien Cs.Vs-x ,CbVb-x mais on a x pour CH3COO- et non O
à l'équivalence ,il suffif de mettre Xe à la place de x
à l'équivalence Cs.Vs-Xe =0 donc CsVs=Cb.Vb(eq)
à partir du graphique on détermine Vb(eq) ce qui permet de calculer Cs
100g de solution S a un volume de 100mL car  =1,00g/mL
=1,00g/mL
n(CH3COOH)s=Cs*V=Cs*0,1
Dans 100g de vinaigre ,il y a 10 fois plus de CH3COOH que dans la solution S
Tu dois pouvoir finir
pour attacher ton image,tu l'enregistres sur ton Disque dur puis tu utilises l'icône Img sous la fenêtre de lecture.
je reconnais que tes explications sont claires mais j'ai du mal a avancé cela fait maintenant 30min sans avoir fait les calculs je ne voit pas qu'elle formule utilisé pour la concentration molaire je dispose d'une formule : [X]=na/V mais na=en mol je ne le connais pas alors je ne peut le faire, et pour calculer la quantité de matière d'acide acétique contenue dans un litre de vinaigre dois utilisé la formule suivante:
n= p.v/M avec p=1000 V=1000 et M avec 60 pour calculer 1 litre?
où ai-je rien piger?
as tu compris comment on calcule Cs en utilisant le graphique?
à l'équivalence ,on a Vb(eq)=13,5mL
à l'équivalence , Cs*Vs=Cb*Vb(eq)
Cs=Cb*Vb(eq)/Vs
avec Vs=10mL ,Vb(eq)=13,5mL Cb=0,10mol/L
Cs=0,1*13,5/10
Cs=0,14 mol/L
Le vinaigre étant 10 fois plus concentré que S,la qté de matière d'acide acétique dans 1L de vinaigre est n=1,4 ml/L
la masse de'acide est
m=n*M=1,4*60= 84 g
il y a 84 g d'acide acétique dans 1L soit 8,4g dans 100mL.
Comme  =1g/mL ,il y a 8,4 g d'acide acétique dans 100g de vinaigre .
=1g/mL ,il y a 8,4 g d'acide acétique dans 100g de vinaigre .
Ce vinaigre titre donc 8,4°
je me méfie des formules quand elles ne sont pas assez détaillées
dans cet exercice, est la masse volumique du vinaigre ,c'est à dire de la solution acide +eau.
est la masse volumique du vinaigre ,c'est à dire de la solution acide +eau.
 =m(solution)/V(solution)
=m(solution)/V(solution)
attention de ne pas confondre m(solution) et m(acide)
m(acide)=n(acide)*M(acide)


