Inscription / Connexion Nouveau Sujet
Constante d'équilibre
Bonsoir,
Jaimerais avoir quelques indication sur la constante déquilibre d'une réaction doxydo-réduction qui est celle ci :
C6H14O6 (aq) + NAD+ (aq) = C6H12O6 (aq) + NADH (aq) + H+ (aq)
Comment pourrai-je calculer sa constance d'équilibre s'il vous plait Puis, est-elle fonction du pH du milieu?
Bonjour, les deux demi-réactions NAD+ + 2H+ + 2e- = NADH + H+ ; E°(volts)=-0.32 pour [NAD]=[H+]=[NADH]=1mol/l , 25°C , pH=7.0 et C6H14O6 (hexane-hex 1,2,3,4,5,6 ol ?)= C6H12O6 (glucose?) + 2H+
[C6H12O6]*[NADH]*[H+]/[C6H14O6]*[NAD+]
Bonjour, je ne comprends pas ce que vous avez fait...
Moi jai bien : [C6H12O6]*[NADH]*[H+]/[C6H14O6]*[NAD+]
Mais comment pourrai-je avoir les concentrations à l'aquilibre des produits?
Je nai que[S]éq=[C6H14O6]éq = [NAD+]éq=8,59.10^-3 mol.L-1.
Comment pourrai-je avoir les concentrations de [C6H12O6] et [NADH]?
Je nai que ces données suivantes...:
-le pH cellulaire est invariable : pH=7 ;
-les concentrations initiales en S et NAD+ sont : [S]i= [NAD+]i= 0.010 mol.L-1 ;
-les concentrations initiales en F et NADH sont : [F]i= [NADH]i= 1,0.10 ^-5mol.L-1 ;
- à 298 K, on mesure les concentrations suivantes : [S]éq = [NAD+]éq=8,59.10^-3 mol.L-1.
(NB. [S]=[C6H14O6])
Bonjour, à l'équilibre , il me semble, les concentrations [C6H14O6]=[C6H12O6]=[NAD+]=[NADH] et à pH=7 [H+]=10^-7 ,donc la constante d'équilibre dépend du pH
Ah daccord... Donc les concentrations sont les memes sauf pour celle de H+
Donc après cela, comment pourrai-je avoir le sens spontané du système?
Bonsoir, comme [NADH]i>[NADH]eq donc va diminuer en étant consommé et [NAD+]i<[NAD+]eq donc va augmenter et être produit , tu déduis que le sens spontanné de la réaction est vers la gauche
[NAD+]i= 0.010 mol.L-1
[NAD+]éq=8,59.10^-3 mol.L-1
excuses , c'est juste le contraire
et [NADH]i= 1,0.10 ^-5mol.L-1 et[NADH]eq=8,59.10^-3 mol.L-1 , excuses c'est juste le contraire donc vers la droite
Ah ok.. Mais ne faut-il pas plutot comparé le K au pH?
Jai aussi une autre question,
"il peut arriver, à cause d'un dysfonctionnement, que le pH de la solution aqueuse cellulaire varie.
a. Calculer les valeurs de Qr,i pour un pH fixé, variant de 1 à 13 par saut de deux unités. On prendra les concentrations initiales des réactifs et des produits, définies dans la question 2.b.
b. En déduire, pour chaque valeur de pH, le sens d'évolution spontanée du système."
Concrètement ici, je dois calculer tout les Qr,i en changeant le [H+] = 10-pH?
k=[C6H12O6]*[NADH]*[H+]/[C6H14O6]*[NAD+] (a)
si pH 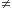 7 alors [H+]
7 alors [H+]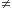 10^-7 dans la relation (a) et les concentrations à l'équilibre seront aussi modifiées quoique égales entre elles dans la relation (a). Tu compareras avec les concentrations initiales et tu en déduiras le sens spontanné!
10^-7 dans la relation (a) et les concentrations à l'équilibre seront aussi modifiées quoique égales entre elles dans la relation (a). Tu compareras avec les concentrations initiales et tu en déduiras le sens spontanné!
Ok merci beaucoup et sur une courbe, comment est ce que je peux identifier le pHmin pour qu'une réaction doxydation ait lieu?
l'oxydation de C6H14O6 en C6H12O6 est une augmentation du nombre d'oxydation d'un atome de carbone (de -1 à +1)
elle a lieu dans le sens de la réaction vers la droite, donc tant que le pH ne change pas le fait que [NAD+]i>[NAD+]eq c'est une oxydation . Sur la courbe tu devrais observer un extremum pour la valeur du pHmin
Jai un ENORME probleme!
Jai calculé tous les Qr,i avec les pH = 1, 3, 5, 7, 9, 11, 13 avec les concentrations initiales
Mais je nai pas de pic, ma courbe est décroissante et descent de 10-2 à chaque fois!!
Vous me dites que "les concentrations à l'équilibre seront aussi modifiées" Mais comment dois je faire pour avoirs les concentrations a l"quilibre si aucune données ne mest donnée?



