Inscription / Connexion Nouveau Sujet
composés organiques
bonsoir à tous ! je bute sur mon exercice de physique ! si quelqu'un veut bien m'aider ,ca serait tres gentil ! merci d'avance pour vos réponses !
1/ en utilisant les deux tableaux (ci-joint)
a/ écrire la formule brute du buthane
b/ écrire la formule développée du propane
c/Un hydrocarbure a pour formule
semi-dévelopée CH3-CH(double trait)CH - CH3
¤ écrire sa formule développée
¤ écrire sa formule brute
¤ justifier le fait que cet hydrocarbure est le buthène
2/on réalise la combustion du méthane CH4
l'équation bilan de et réaction chimique s'écrit littéralement
méthane + dyoxygène (flèche) dioxde de carbone + eau
a/ écrire en utilisant les formules chimiques , l'équation bilan de la réaction et l'équilibrer
b/ calculer le nombre de moles de méthane qui correspond à 16g de ce gaz
c/ calculer le volume de dioxygène nécessaire à la combustion de 16g de méthane
information : le volume molaire des gaz : 24L.mol-1
masses molaires atomiques : M(C) = 12g.mol-1
M(O) = 16g.mol-1
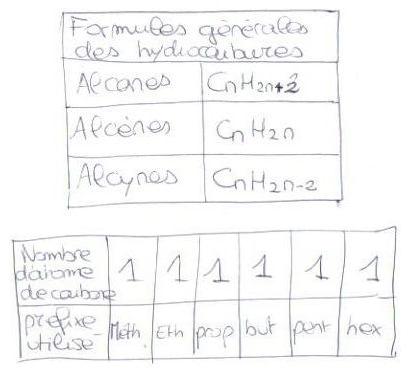
Attention la ligne de ton deuxieme tableau est fausse! c'est "1 meth, 2 eth, 3 prop,4..."
Pour la premiere question: buth/ane ---> alcane a 4 carbones Donc C4H10 avec n=4
merci beaucoup de répondre saliah999 !  pour le tableau les chiffres sont bons sur mon livre c'est bien "1méth, 1 éth ,1 prop ... "
pour le tableau les chiffres sont bons sur mon livre c'est bien "1méth, 1 éth ,1 prop ... "
Pour le b) je ne peut te l'écrire en développé avec mon clavier.
Prop/ane---> alcane a 3 carbones donc n=3 d'où C3H8
En semi développé ca te donne CH3-CH2-CH3 (développe simplement les H!)
Pour le c) en comptant les atomes tu trouve C4H8 soit une molécule de la forme CnH2n avec n=4 et pour formule brute C4H8 c'est donc un alcene et plus précisément le buthene (buth=4)
CH4 + 2 O2 --> CO2 + 2 H2O
PV=nRT tu veux trouver V donc V=nRT/P
or n=m/M donc V=mRT/PM
as-tu P et T ??
oui j'arrive à comprendre un peu ! mais comme j'ai peur de me tromper je n'ai pas confiance en mes reponses ! 
pour le b/ ? c'est bon ???
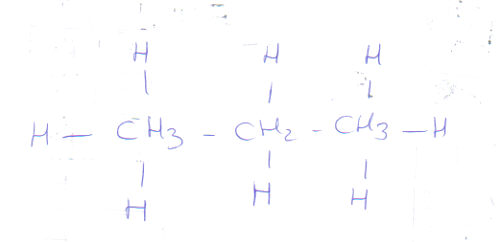
tu mélanges la formule développée et semi développée.
Suprime les H3 et H2 pour que la formule développée soit correcte.
il faut qu'il y ait 4 tirets (liaisons ) qui partent des C
En formule semi développée on écrira
CH3-CH2-CH3
(Je n'ai pas encore lu les réponses précédentes)
Pour le 2)
n(C4H10)=m/M
d'après l'équation
n(C4H10)= n(O2)/2 donc n(O2)=2n(C4H10)
d'autre part,pour les gaz
n=v/VM
donc v=n.VM
v(O2)=n(O2).VM
dans l'énoncé VM=24L/mol
avec ça tu devraits te débrouiller
de me tromper je préfère te demander ! meme si c'est peut etre une question bête!
je remplace tes lettres par des nombres 
pour écrire la formule développée du butène,tu commence par écrire le squelette carboné ,
C-C=C-C
puis tu rajoutes tirets qui forment les liaisons avec les H.
Donc 3 tirets supplémentaires autour du 1er carbone ,1 à partir du 2ème et 3ème C et 3 autour du 4ème C
Toujours vérifier qu'il y a (ou qu'il n' y a que) 4 tirets partant d'un carbone
Il s'agit du butène
but...car la chaîne carbonée a 4 C
...ène car il y a un double liaison (c'est conc un alcène)
pour répondre à ta question,il faut remplacer les lettres par les valeurs numériques;
je t'ai fourni les expressions littérales
tu fais l'application numérique
pour le 2 / je trouve :
n=v/VM
n=16/24
n=0.666
le nombre de moles de méthane qui correspond à 16g de ce gaz est de 0.666
c'est bon ou je patauge ???
salut !
pour la 2)c/
je trouve 16*48/24 = 32L
le volume de dioxygène nécessaire à la combustion de 16g de méthane EST DE 32 L
c'est bien ça ????




