Inscription / Connexion Nouveau Sujet
Cinétique électrochimique
Bonjour , s'il vous plait je trouve des problème dans un exercice de cinétique électrochimique est ce que vous pouvez m'aider?
Enonce:
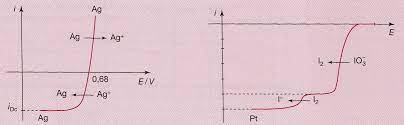
On donne les courbes intensité - potentiel suivantes :
-courbe du système Ag+(C0 = 1,0.10-2 mol.L-1) / Ag(s) sur électrode d'argent (figure 1).
-courbe de réduction sur platine d'une solution d'iodate IO3- successivement en diiode I2 puis en iodure I- (figure 2).
1) Commentaires sur la figure 1 :
a) Pourquoi n'observe-t-on pas de palier de diffusion anodique pour le système Ag+/ Ag ?
b) Pour ce même système, vérifier numériquement la valeur du potentiel à l'équilibre. On donne
E°(Ag+/ Ag) = 0,80 V.
c) Ce système est-il rapide ou lent ?
2) Commentaires sur la figure 2 :
On donne E°(IO3-/ I2) = 1,19 V et E°(I2 / I-) = 0,54 V.
a) Commenter la figure.
b) Pourquoi observe-t-on des vagues de réduction de hauteur différente ?
c) Prévoir l'allure de la courbe d'oxydation d'une solution d'iodure sur platine.
-----------------------------------------------------------------------------------
Réponse:
Partie 1:
1- car on a un transfert de charge
2- d'après la relation de NERNST
E(Ag+/ Ag) = 0,80 + 0,06 x -2= 0,68 V
3- c'est une réaction rapide nous avons pas des surtensions anodiques ou cathodiques
Partie 2:
1- on remarque qu'on a un transfert de matière c'est pour cela qu'il y a palier de diffusion
2- car on a des potentiel d'équilibre différente
3- j'ai pas répondu
-------------------------------------------------------------------------------
je sais pas si mes réponse sont juste ou non pouvez vous m'aider?
Merci d'avance
Bonsoir,
Partie 1 :
1- Oui mais c'est surtout parce que l'électrode constitue le réactif (Ag(s)) qui est consommé lors de l'oxydation, donc il y a pas de limitation par le transport de matière.
2- Ok
3- Oui, car le potentiel est bien définie et que le transport de matière est limitant.
Partie 2 :
1- Oui mais pas seulement, on constate deux vagues réductions successives et une surtension cathodique.
2- Non, la hauteur des vagues de diffusion dépend de la quantité d'électricité échangée et donc du nombre d'électron mis en jeu lors de la réduction. Ici tu pourras vérifier que la hauteur est proportionnelle au nombre d'électron échangé dans les réductions.
3- As tu une idée de l'allure ?



