Inscription / Connexion Nouveau Sujet
Cinetique d'une transformation lente
Bonjour ! Voila j'ai un devoir maison à faire et je bloque sur la partie chimie... si vous pouvez m'expliquer.. pascque je suis perdu !
On se propose d'étudier la cinetique de la transoformation lente de decomposition de l'eau oxygénée par les ions iodure en rpesence d'acide sulfurique, transoformation considérée comme totale.
L'équation de la reaction qui modelise la transformation d'oxydoreduction s'écrit:
H2O2 (aq) + 2I- (aq) + 2H3O+ (aq) = I2 (aq) + 4H2O (l)
La solution de diiode formée etant colorée, la transformation est suivie pas spectrophotometrie.
A la date t=0 s, on melange 20,0 mL d'une solution d'iodure de potassium de concentration 0,10 mol/L acidifiée avec de l'acide sulfurique en exces, 8,0 mL d'eau et 2,0 mL d'eau oxygénée à 0,10 mol/L.
Le suivi conduit au tableau de resultats suivant :
t(s) 0 126 434 682 930 1178 1420
[I2] (mmol/L) 0,00 1,74 4,06 5,16 5,84 6,26 6,53
1)a) Le melange initial est il stoechiometrique ?
b) Etablir le tableau descriptif de l'évolution du systeme ( tableau d'avancement)
c) Etablir la relation [I2] et l'avancement x de la transoformation.
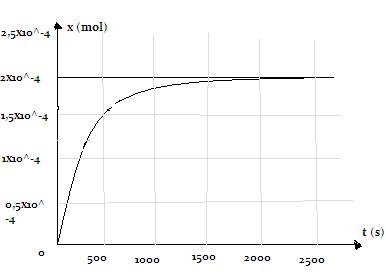
d) La courbe represente les variations de l'avancement x de la transformation en fonction du temps : montrer que cette courbe a été obtenue à partir des valeurs du tableau de valeur ( t;[I2]) par exemple en calculant la valeur de x.
e) Determiner l'avancement maximal. En deduire la valeur theorique de la concentration en diiode formé lorsque la transformation est terminée.
2)a) Donner la composition du melange reactionnel à t= 300 s
b) Comment varie la vitesse volumique de reaction ? Justifier
Quel facteur cinetique peut etre responsable de cette variation?
c) Determiner le temps de demi reaction.
Voila, jespere que vous pourrez m'aider ! En vous remerciant d'avance 

et desolée pour la qualité de la courbs :s
1) le mieux serait donc de calculer les quantités initiales il me semble non. Rien que l'équation suffit
mais le tableau davancement, jusque là jy arrive
mais c'est à partir de la question c que je comprend pas....
salut:
1)a) on a:
no(I-)=c1.v1=0,10 mol/L.20.10-3 L=2.10-3 mol
no(H2O2)=c2.v2=0,10 mol/L .2.10-3 L=2.10-4 mol
or d'après la réaction :
H2O2 + 2I- + 2H3O+ = I2 + 4H2O
1mol de H2O2 doit réagir avec 2 mol de I- .
donc 2.10-4 mol de H2O2doit réagir avec 4.10-4 mol de I- .
alors qu'on a utilisé 2.10-3 mol de I- donc I- est en excès.
d'ou Le mélange initial n'est pas stoechiometrique .
-------------------------------------------------------------------
b) tableau descriptif de l'évolution du systeme ( tableau d'avancement)
H2O2 + 2I- + 2H3O+ = I2 + 4H2O
2.10-4 mol 2.10-3 mol .... 0 excés
2.10-4 -x 2.10-3 -2x .... x excés
-------------------------------------
c)la relation [I2] et l'avancement x de la transoformation.
[I2]=x/V avec V=v1+v2+veau=20+8+2=30mL
-------------------------
d) La courbe represente les variations de l'avancement x de la transformation en fonction du temps :
montrons que cette courbe a été obtenue à partir des valeurs du tableau de valeur .
en effet:
d'après le tableau de valeur on a :
à t(s) = 126 s [I2]= 1,74 010-3 mol/L
or: [I2]=x/V donc : x=[I2].V= 1,74 10-3 mol/L .30.10-3 L=0,522.10-4 mol
c'est bien la valeur qu'on trouve en lisant la courbe à cette instant.
--------------------
e) Determinons l'avancement maximal.
H2O2 est limitant car I- est en excès .
2.10-4-xmax=0
xmax= 2.10-4mol
la valeur theorique de la concentration en diiode formé lorsque la transformation est terminée.
[I2]=xmax/V =2.10-4mol /30.10-3=6,67.10-3 mol/L
waaa merci beaucoup, juste un truc
no(I-)=c1.v1=0,10 mol/L.20.10-3 L=2.10-3 mol
no(H2O2)=c2.v2=0,10 mol/L .2.10-3 L=2.10-4 mol
euh.... j'ai pas compris le 20.10-3 L=2.10-3 mol
ca sort d'où ????
question pour la deuxieme partie :
je comprend jamais quand on me demande de donner la composition du melange a un t donné......
pour le comment varie la vitesse volumique de reaction... je pense que je dois dire qu'elle augmente puis se stabilise vers les 1200 s ....
facteur cinetique... ???
et le temps de demi reaction je dois juste divisé par deux xmax nn ???
merci bocoup !
salut:
La vitesse volumique est la dérivée par rapport au temps de l'avancement volumique divisée par le volume :
v = 1/V  dx/dt
dx/dt
Cette vitesse à une date t correspond aussi au coefficient directeur de la tangente à la courbe divisé par le volume.
tu as une courbe donc tu peux tracer la tangente à cette courbe au temps demandé et calculer son coefficient directeur a en choisissant 2 points. et
tu contateras alors que sa valeur diminue jusqu'à ce qu'elle s'annule,à partir de 1200s la vitesse de la réaction devient nulle.
merci tous le monde !
juste un truc la PREMIERE question je pense que c faux.. le melange est stoechiometrique ... pacque en recalculant jai trouver n0(H202) = 0,10 x 0,10.10^-3 = 1,0.10^-3 mol....
et en calculant k on a
k(I-) = n0(I-)/2 = 1,0.10-3 mol
k(H202) = 1,0.10-3 mol
donc c stoechiometrique...
mais du coup je trouve xmax = 1,0.10-3 mol
jcapte plus rien la XD
help !
mais qu'est ce que tu racontes? .
voilà ce que nous avons:
A la date t=0 s, on melange v1=20,0 mL d'une solution d'iodure de potassium de concentration c1=0,10 mol/L acidifiée avec de l'acide sulfurique en exces, 8,0 mL d'eau et v2=2,0 mL d'eau oxygénée à c2= 0,10 mol/L.
donc:
no(I-)=c1.v1=0,10 mol/L.20.10-3 L=2.10-3 mol
no(H2O2)=c2.v2=0,10 mol/L .2.10-3 L=2.10-4 mol
or d'après la réaction :
H2O2 + 2I- + 2H3O+ = I2 + 4H2O
1mol de H2O2 doit réagir avec 2 mol de I- .
donc 2.10-4 mol de H2O2doit réagir avec 4.10-4 mol de I- .
alors qu'on a utilisé 2.10-3 mol de I- donc I- est en excès.
d'ou Le mélange initial n'est pas stoechiometrique .
okay !
(c un pote qui ma sorti tout ce bordel XD)
bon jvai faire comme ta fait c nettement plus clair XD
et pour la vitesse jai trouver le coef directeur donc jpense que c bon ...
merci beaucoup de ta patience XD
jai pas compris ce que je dois dire pour le 3)a)... ok jai ma courbe je dit qu'il ya 1,125.10^-4 mol...???
je redige comment ?


