Inscription / Connexion Nouveau Sujet
Cinétique chimique
, on réalise en présence de catalyseur la réaction de décomposition du peroxyde d'hydrogène eau oxygénée de formule H2O2 en eau et en dioxygène. On considèrera que le volume de la solution aqueuse de faire aussi d'hydrogène reste constant et que le volume molaire gazeux est Vm= 24 mol/l on utilise V = 10 ml de molarité C = 6 x 10 ^- 2 mol/l on ajoute quelques gouttes de catalyseur et on ouvre diverses instant T le volume V02 dégager. les résultats sont indiqués dans le tableau ci-dessous .
1) écris l'équation du nom de réaction de la décomposition de l'eau oxygénée.
2) montrer que la concentration de [H2O2] restant =(C-2Vo2)/(V.Vm)
3)recopier et compléter le tableau
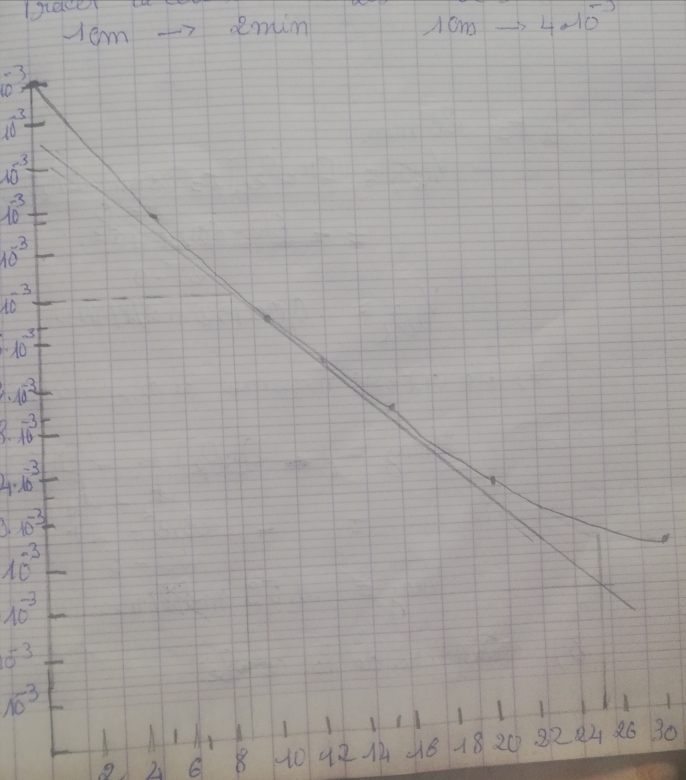
4) tracer la courbe de la concentration de H2O2 restant en fonction de t échelle abscisse 1 cm pour 2 minutes ordonnée 1 cm pour 4 x 10 ^-3
5) données la définition de la vitesse instantanée de disparition de l'eau oxygéné.
6) déduire la coupe de la valeur de la vitesse instantanée de disparition de H2O2 exprimer en mode parmi par minute au data To= 0 min et T =25 min
7) quelle est la vitesse moyenne de disparition de l'eau oxygénée de l'eau accéder entre 5 et 20 minutes
8)déduire aussi de la courbe la date à laquelle le volume de dioxygène est égal à 2,40ml
Bonsoir s il vous plaît j ai besoin d'aide pour cet exercice ci dessus
Pour les questions 6,7,8 expliquer moi un peu comment procéder merci
Bonjour
Après avoir écrit l'équation bilan de la réaction, il faut remplir un tableau d'avancement. Cela te permets de répondre à plusieurs questions déjà. Il faudrait que tu scannes et postes ici le tableau de valeur et la courbe que tu as obtenue à titre de vérification.
Ensuite, la vitesse instantanée fait intervenir la dérivée de la concentration par rapport au temps. Graphiquement, cela peut se déduire du coefficient directeur de la tangente à la courbe.
Attention : la formule donnant [H2O2], telle que tu l'as copiée, est fausse. La parenthèse ouvrante est mal placée : elle demande de soustraire un volume à une concentration, ce qui n'a pas de sens. On ne peut en physique que soustraire ou additionner des grandeurs ayant la même dimension.
Cela est sans conséquence car tes calculs de concentrations sont corrects. Évidemment, avec si peu de points expérimentaux et l'absence de papier millimétré, difficile d'être précis pour la suite. Tu peux tout de même indiquer ici tes résultats. Je vérifierai.
Pour t'aider un peu :
j'ai placé les points expérimentaux (croix rouges) dans un repère puis tracé la courbe moyenne. Pour obtenir les vitesses instantanées à t=25mm (pointillés rouges) et à t=0 (même principe)
Pour la vitesse moyenne entre t=5min et t=20min, il faut s'intéresser au coefficient directeur de la droite passant par ces deux points (pointillés verts).
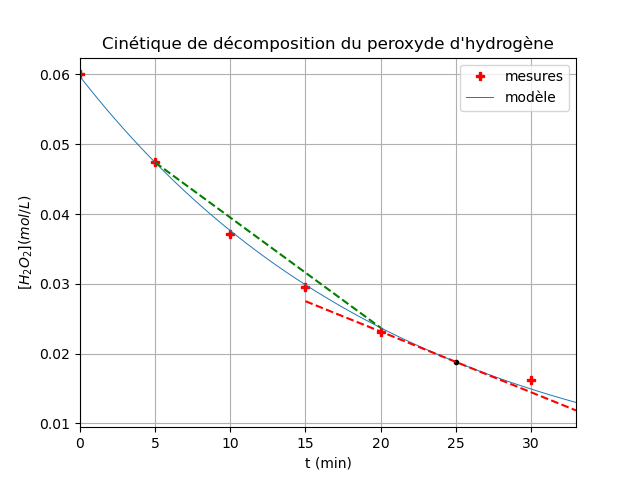
Pour la vitesse instantanée à t=25min j'ai trouvé :
Vh202=[(12-60)×10^-3]\[25-0]
Vh202=0, 00192mol/l/min
Quant à la vitesse moyenne entre 5 et 20min
Vmoy=(-23,2+47)/(20-5)
Vmoy=1,59mol/l/min
j'ai mal recopie cette formule :[H202] restant=C-[(2Vo2)/(V.Vm)]. Merci
Pour t=0min je ne sais pas comment m y prendre
D'accord avec toi pour la vitesse moyenne entre t=5min et t=20min. En revanche, tu n'as pas bien compris la méthode de détermination des vitesses instantanées. Par définition, la vitesse instantanée de disparition de H2O2 est :
Or, la dérivée par rapport au temps est égal au coefficient directeur de la tangente à la courbe [H2O2]=f(t). Il suffit donc graphiquement de tracer cette tangente, d'en déterminer le coefficient directeur puis d'inverser le signe.
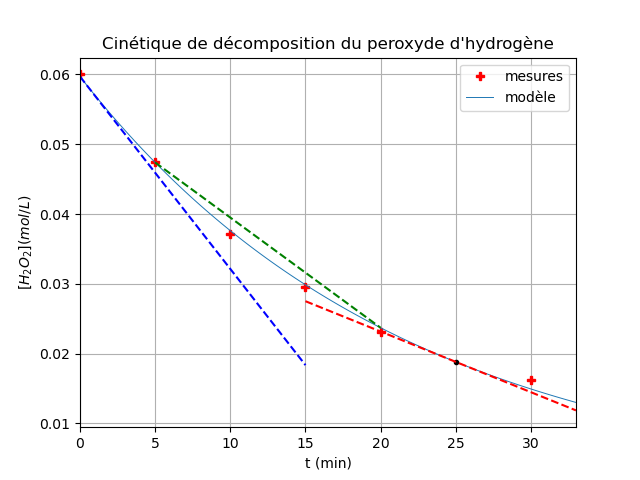
Pour t'aider, j'ai tracé la tangente à la courbe en t=0 (pointillés bleux) et en t=25min (pointillés rouges).
Donc j ai refais les calcul à t=omin
V=(0-60×10^-3)/(15-0)
Vh202=0,004mol/l/min
à t=25min
Vh202=[(60-17)×10^-3]\(0-25)
Vh202=0,00172mol/l/min
Prenons la tangente en t=0min.
Elle passe par le point (0min, 60mmol) et par le point(15min, 18,5mmol) pas par le point (15min, 0mmol). Regarde bien la ligne pointillée bleue.
Pour la tangente en t=25min (pointillés rouge) on peut, par exemple, prendre les points (15min, 27,7mmol) et (33min, 12,1mmol)
On peut donc prendre des points quelconque pour calculer le coefficient directeur de la tangente après l' avoir tracer à l instant t ?
Le point de tangence est imposé par l'énoncé : le point de la courbe d'abscisse t=0 ou celui d'abscisse t=25min.
Une fois une tangente tracée, tu peux choisir deux points quelconques de cette droite pour déterminer le coefficient directeur. Pour une bonne précision graphique, il est préférable de les prendre assez éloignés l'un de l'autre. C'est un peu comme si, en math, on te demandait de trouver l'équation d'une droite. Pour cela, il suffit de connaître les coordonnées de deux points quelconques appartenant à cette droite.
Ce volume correspond à une concentration en eau oxygénée de 40mmol/L. Graphiquement, je ne vois pas comment tu peux obtenir un résultat précis à la seconde près. Personnellement, j'obtiens :
t  8,5min.
8,5min.
Juste une remarque sur la présentation des résultats numériques. Bien sûr : 30s=0,5min ; cependant, présenter, comme ici le résultat sous la forme t=8,5min ou sous la forme t=8min30s n'a pas tout à fait la même signification physique. C'est une question de chiffres significatifs (voir éventuellement cette fiche de cours sur le forum : ![]() Les chiffres significatifs )
Les chiffres significatifs )
Quand j'écris t=8,5min, j'estime mon résultat précis au dixième de minute près donc à 6s près. Pour arriver à cela, j'ai utilisé un logiciel qui trace la courbe moyenne et la modélise mathématiquement. Si tu écris t= 8min30s, tu estimes ton résultat précis à la seconde près, ce qui me parait un peu illusoire avec aussi peu de points expérimentaux et l'absence de papier millimétré.