Inscription / Connexion Nouveau Sujet
Cinétique chimique
Bonjour/Bonsoir
Je rencontre des difficultés en cinétique et en particulier pour ce qui est de chercher des vitesses graphiquement .
Merci de m'aider sur cet exercice.
On réalise la décomposition catalytique du peroxyde d'hydrogène de formule H2O2 dans un ballon maintenu à température constante.
A un instant pris comme origine des dates,on verse dans le ballon contenant déjà le catalyseur,une quantité d'eau oxygénée nécéssaire pour que la solution ait un volume de 1L et une concentration C0=5.10-2mol.L-1 en eau oxygénée. La mesure du volume de dioxygène dégagé a permis de déterminer la concentration molaire volumique C en eau oxygénée. Cette concentration varie en fonction du temps dans l'intervalle [0,6h] selon la loi suivante:C=C0e-kt avec k=0,464h-1.
1.Ecrire l'équation-bilan de la réaction de décomposition de l'eau oxygénée. Potentiels normaux des couples:O2/H2O2(0,68V);H2O2/H2O(1,77V).
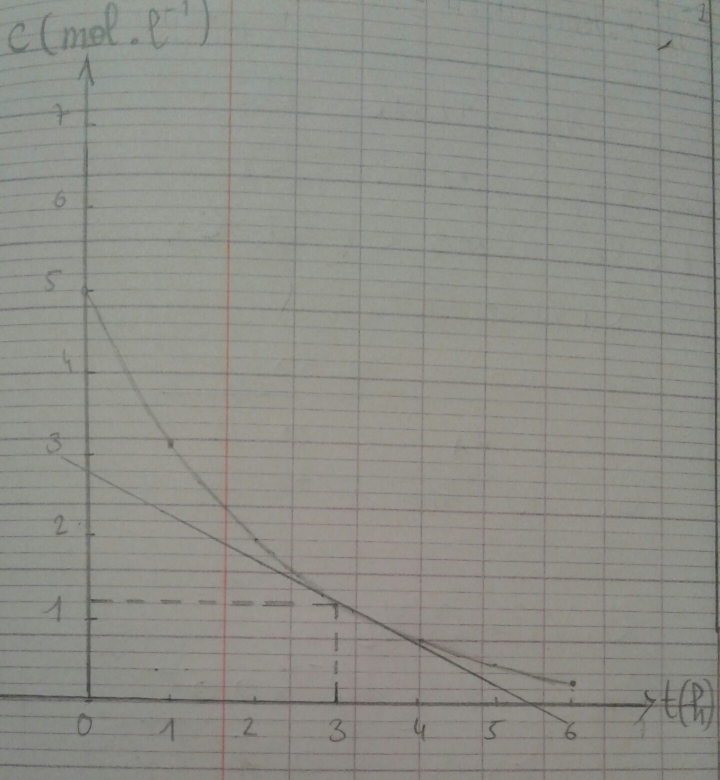
2. Tracer la courbe C=f(t) dans l'intervalle [0,6h].
3. Donner l'expression de la vitesse v de disparition de l'eau oxygénée en fonction du temps . Calculerv pour t=3h.
4. Retrouver ce résultat graphiquement.
5. Defenir le temps de demi-réaction sachant que la réaction est totale. Déterminer graphiquement puis par le calcul.
Voilà ce que j'ai fait:
1. H2O2  O2+2H++2e-
O2+2H++2e-
H2O2+2H++2e- 2H2O
2H2O
 2H2O2
2H2O2 O2+2H2O.
O2+2H2O.
3.
Pour t=3h je trouve v=5,8.10-3mol.L-1.h-1
4. Je n'arrive pas à retrouver le résultat avec ma courbe
Merci de me corriger
Bonjour,
Questions 3 et 4 :
Je trouve (presque) comme toi :
et je trouve comme toi que v(3)=5,78.10-3 mol.L-1.h-1
Tu dois donc avoir un problème avec ta détermination graphique.
J'ai appliqué la formule mais je ne trouve pas ce résultat avec ma courbe et pourtant je ne vois pas l'erreur
Tu aurais intérêt à utiliser un papier quadrillé à petits carreaux, voire du papier millimétré pour gagner en précision.
Sur ton schéma je lis tan( )
) 2,8/5,4 = 0,52
2,8/5,4 = 0,52
Soit V(3) = 5,2.10-3 mol.L-1.h-1
Sur le mien je lis V(3) = 0,03/5,15 = 5,8.10-3 mol.L-1.h-1
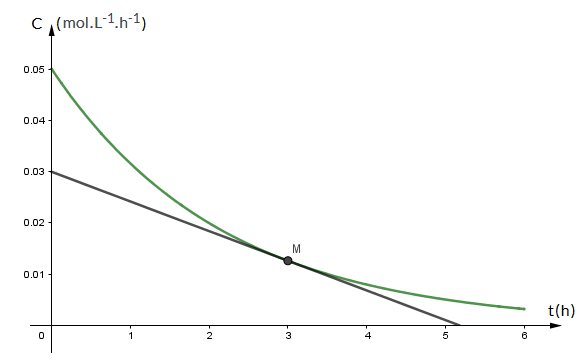
Bonsoir
Je m'excuse pour le retard
J'ai revu ma tangente et je trouve bien v=5,8.10-3mol.L-1.h-1
Et pour le temps de demi-réaction j'ai t1/2=1,5h
Merci de me corriger