Inscription / Connexion Nouveau Sujet
chimie volume équivalent
Bonjour, pourriez vous m'aider à faire cet exercice de chimie?
Le voici:
Soit un vin affichant 12,0°, ce qui signifie que cent millilitres de vin contiennent 12,0mL d'éthanol pur.
L'éthanol a pour formule CH3CH2OH et forme un couple avec l'acide éthanoïque CH3COOH. L'éthanol pur est liquide et a pour densité d=0,789.
On a les conductivités molaires ioniques suivantes en mS.m².mol-1
K+->7,35
Mn2+->10,7
H3O+->35,0
Cl-->7,63
MnO4-->6,13
On réalise un titrage conductimétrique d'une solution S fabriquée ainsi:
-10,0mL de vin dilué cent fois
-90mL d'acide chlorhydrique de sorte que, dans la solution S, on ait les concentrations suivantes:
[H3O+]=[Cl-]=c1=1,00.10-2 mol.L-1
On utilise une solution titrante de permanganate de potassium de concentration c=1,20.10-2mol.L-1
L'ion permanganate MnO4- forme un couple avec l'ion manganèse Mn2+
1)Calculer la concentration en éthanol du vin si l'étiquette est correcte. On la notera c0.
2)Déterminer la nature du couple formé par l'éthanol et l'acide étahnoïque et donner un nom général à ces deux espèces.
3)Faire le schéma légendé du montage de titrage conductimétrique.
4)Déterminer l'équation de la réaction de titrage ainsi que le volume équivalent obtenu si l'étiquette est correcte.
5)Tracer l'allure de la courbe donnant la conductivité  de la solution en fonction du volume V de solution titrante versé en supposant que l'étiquette est correcet et que la solution S ne contient pas d'autres ions que H3O+ et Cl-. On négligera la dilution et considérera le volume total comme constant, V0=100mL.
de la solution en fonction du volume V de solution titrante versé en supposant que l'étiquette est correcet et que la solution S ne contient pas d'autres ions que H3O+ et Cl-. On négligera la dilution et considérera le volume total comme constant, V0=100mL.
On justifiera l'allure tracée.
6)On trouve un volume équivalent Vé=11,7mL. En déduire le degré réel du vin.
________________________________________________
1)Le volume est de 90+10,0=100mL
Dans ces 100mL on a 12mL d'éthanol pur.
On cherche c0, on a le volume et comment avoir la quantité de matière?
2)On peut écrire l'équation d'oxydoréduction suivante:
CH3CH2OH +H2O = 4H+ + 4e- + CH3COOH
CH3COOH est un oxydant
CH3CH2OH est un réducteur
3)Ok
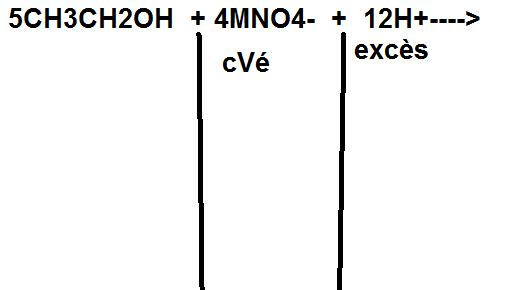
4)5 CH3CH2OH + 4 MnO4- + 12H+ = 5 CH3COOH + 4 Mn2+ + 11 H2O
Sauf que là je ne tiens pas compte de l'acide chlorhydrique 
5)?
6)?
Merci d'avance
Bonjour
1) Dans le vin on a 12mL d'éthanol pur. Il faut utiliser la densité pour calculer Co...
2)3) ok
4) bien sur que si t'en tiens compte...avec les H+...
5) Pour V<Véq : quels ions sont présents?
Pour V>Véq : quels ions reste-t-il?
4)Je ne comprends pas.. pourquoi ça serait juste? aucun Cl-n'apparait
5)Quels ions sont présents dans la solution titrée tu veux dire?
Pour V<Vé je dirais K+, Cl-, H3O+
pour V>Vé je dirais K+ et Cl-
Bonjour,
Dans un volume V=100mL de vin, on a un volume V'=12,0mL d'éthanol. On a donc une masse m=dV' eau d'éthanol. Soit une quantité de matière n=dMéthanolV'
eau d'éthanol. Soit une quantité de matière n=dMéthanolV' eau d'éthanol...
eau d'éthanol...
Qu'est-ce que la densité d de l'éthanol ? C'est le rapport entre les masses volumiques d'éthanol et d'eau : d= éthanol/
éthanol/ eau.
eau.
Qu'est-ce que la masse volumique de l'éthanol ? C'est le rapport entre la masse et le volume d'éthanol :  éthanol=m/V'.
éthanol=m/V'.
Donc si on a un volume V' d'éthanol, la masse d'éthanol vaut m= éthanolV'. Or
éthanolV'. Or  éthanol=d
éthanol=d eau d'après la définition de la densité de l'éthanol (que j'ai rappelée plus haut).
eau d'après la définition de la densité de l'éthanol (que j'ai rappelée plus haut).
D'où, finalement, m=dV' eau.
eau.
C'est compris ?
Oui 
1) eau=1 kg/L
eau=1 kg/L
m=0,789*12.10-3*1
m=9,46.10-3kg
m=0,946 g et on a bien trois chiffres significatifs
M(éthanol)=46,0 g.mol-1 d'après moi
n=m/M(éthanol)
n=0,946/46=2,06.10-2mol
c0=n/V' avec V'=12,0mL
c0=2,06.10-2/12.10-3
c0=1,71 mol/L
Niveau rédaction c'est pas la joie..
Ne t'embête pas à faire tout plein de calculs intermédiaires... Mène les calculs littéralement jusqu'à trouver l'expression de c0 PUIS fais l'application numérique.
Néanmoins, il me semble qu'il y a un petit souci dans ce que tu as écris. c0 n'est pas égal n/V' avec V'=12,0mL. Il faut prendre en compte le volume de vin.
La concentration de l'éthanol vaut c0=n/V avec n la quantité de matière de l'éthanol et V le volume de vin.
Or n=m/M (respectivement les masse et masse molaire de l'éthanol) soit n= éthanolV'/M où V' est le volume de l'éthanol. D'où n=d
éthanolV'/M où V' est le volume de l'éthanol. D'où n=d eauV'/M où d est la densité de l'éthanol.
eauV'/M où d est la densité de l'éthanol.
Soit, finalement, c0=(d eauV')/(MV).
eauV')/(MV).
Or, dans un volume V de vin, il y a un volume V'=DV où D=0,120 est le degré alcoolique du vin (petit produit en croix : si 100mL de vin correspond à 12,0mL d'éthanol, alors un volume V de vin correspond à un volume V'=0,120V d'éthanol).
Donc le volume V' est V'=0,120(10+90)= 12mL oui
Je comprends ton explication. Reste à trouver le bon résultat en remplaçant
c0=0,789* eau*12.10-3/(46,0*1,00.10-1)
eau*12.10-3/(46,0*1,00.10-1)
En quelle unité faut il mettre la masse volumique de l'eau pour que ça colle? n'importe?
Peu importe pour la masse volumique, du moment que c'est cohérent avec les unités choisies pour les autres grandeurs. Si tu choisis de prendre la masse volumique en g/L, alors toutes les masses doivent être exprimées en g et tous les volumes en L.
Tu as choisis d'exprimer la masse molaire en g/mol et les volumes en L, il faut donc exprimer la masse volumique en g/L.
C'est bon, je confirme la réponse. Je voulais vérifier l'ordre de grandeur et Google m'a apporté la réponse : c'est tout à fait ça  (ce qui m'embête, c'est que je ne retrouve pas cette valeur avec la suite de l'exercice... on verra !)
(ce qui m'embête, c'est que je ne retrouve pas cette valeur avec la suite de l'exercice... on verra !)
On verra 
2)J'avais apporté une réponse mais elle me parait fausse car l'acide chlorhydrique est censé ne pas réagir d'après ma réaction, ce qui est louche.
Ta réponse est correcte. Comment ça l'acide chlorhydrique ne réagit pas ? Et les H+ alors ? D'où viennent-ils ?! 
L'acide chlorhydrique est là pour acidifié le milieu, sans quoi la réaction que tu as écrite ne se ferait pas puisqu'elle a besoin de réagir avec des H+.
On réalise un titrage conductimétrique d'une solution S fabriquée ainsi:
-10,0mL de vin dilué cent fois
Ça m'arrangerait si tu me disais que le vin a été dilué 10 fois

Parce que je ne trouve pas une valeur cohérente pour le volume équivalent à la question 4... Que trouves-tu ?
Ben moi j'aurais dit que comme le vin a été dilué 100 fois, la concentration de l'éthanol vaut désormais c'=c0/100. Or on a prélevé 10,0mL du vin qui a été dilué, soit V'=1,20mL d'éthanol d'où une quantité de matière d'éthanol c'V'=c0V'/100.
Du coup, à l'équivalence, on a la relation cVé/4=c0V'/500 d'après la stchiométrie de la réaction). D'où Vé=c0V'/125c.
Sauf que l'application numérique fournit Vé=1,65mL ce qui me paraît suspect... 16,5mL aurait été acceptable (c'est pourquoi je te demandais si le facteur de dilution était bien 100).
Est-ce que toutes les données que tu as tapées sont correctes ? (bonnes puissances de 10, etc.) Sinon, il va falloir trouver mon erreur 
J'ai tout tapé correctement.
Et c'est vrai que vu le volume équivalent cité dans la question 6), Vé=1,65mL est bizarre bizarre..
J'essaie de comprendre ton dernier raisonnement.
J'ai refais tes calculs je trouve la même chose.
C'est peut être c0 qui est faux. Pourtant cette concentration a une bonne tête 
Je n'ai trouvé rien à redire au raisonnement.
Dans ton lien je ne vois pas où est le bon résultat.. tu y vois quelque chose de l'ordre du 1mL pour Vé?
Hum... Soit par rapport à la dilution : la quantité de matière de soluté reste inchangée lors de la dilution donc normalement ça ne devrait pas être méchant. Sauf qu'on ne connaît pas le volume du vin au départ, donc on ne connaît pas la quantité de matière de l'éthanol dans la bouteille de vin. C'est pourquoi j'ai raisonné comme cela :
Ben moi j'aurais dit que comme le vin a été dilué 100 fois, la concentration de l'éthanol vaut désormais c'=c0/100. Or on a prélevé 10,0mL du vin qui a été dilué, soit V'=1,20mL d'éthanol d'où une quantité de matière d'éthanol c'V'=c0V'/100.
Si l'erreur n'est pas là, alors elle doit être avec le volume d'éthanol. On parle de 10,0mL de vin. Mais puisqu'on précise que c'est le volume du vin, le volume d'éthanol doit être plus faible d'après le degré alcoolique de ce dernier. C'est pourquoi j'ai considéré un volume V'=1,20mL.
Mais bon... Je ne vois pas trop là.
Tu crois que ça vaut le coup de continuer l'exo avec notre valeur?
J'attends la réponse de mon prof pour voir si c'est possible mais peu de chances..
Personne d'autre pourrait essayer de voir où ça bloque?
Si on prend le volume de vin de 10,0mL, on obtient quelque chose de cohérent :
Vé=(4*2,06*10.10-3)/(100*5*1,20.10-2)=13,7mL.
Mais bon, je ne vois pas pourquoi on devrait considérer le volume de vin et non celui d'éthanol...
Oui là ça serait parfait mais ce n'est pas logique.
Pourquoi prendre le volume de vin? Pourquoi prendre le volume d'éthanol?
Pourquoi prendre le volume d'éthanol?
Parce que néthanol=céthanolVéthanol. Mais bon, où est l'erreur...
En fait, tout va bien (il fallait juste reprendre ça à tête reposée).
Au départ, on a une quantité (c0/100)V d'éthanol (où V=10,0mL est le volume de vin dans la solution ; ne pas oublier le facteur de dilution !).
À l'équivalence, on apporte une quantité cVé d'ions permanganate.
Or l'équivalence est l'état du système où l'on apporte juste assez de réactif titrant (ions permanganate) pour consommer tout le réactif titré (éthanol), d'où cVé/4=c0V/(5*100) d'après la stchiométrie de la réaction.
Je te laisse extraire Vé 
Donc question 4, je trouve Vé=13,7mL.
Et question 6, avec Vé=11,7mL, je trouve un degré alcoolique 10,2°.
(c0/100)V d'éthanol (où V=10,0mL est le volume de vin dans la solution ; ne pas oublier le facteur de dilution !).
Mais dans le vin ce n'est pas que de l'éthanol !
Arfff... Je t'ai embrouillé avec mes messages précédents...
Quand on a calculé c0, on a fait le rapport entre la quantité de matière d'éthanol n et le volume de vin V.
Donc si on calcule c0V, on obtient la quantité de matière d'éthanol présente dans un volume V de vin.
Ici, la concentration de l'éthanol vaut c0/100 (dilution de facteur 100) et le volume de vin vaut V=10,0mL. Donc (c0/100)V nous donne bien la quantité de matière d'éthanol présente dans la solution titrée : c'est ce qu'on voulait 
Est-ce clair à présent ?
D'abord je reviens sur comment j'ai trouvé l'équation de réaction de titrage, que ça soit bien clair (pour moi surtout) :
On a les couples CH3COOH/CH3CH2OH et MnO4-/Mn2+ car on peut écrire les demi-équations suivantes :
CH3CH2OH+H2O=4H++4e-+CH3COOH X5
MnO4-+8H++5e-=Mn2++4H2O X4
D'où mon équation de titrage.
Yes?
Ton raisonnement est correct, tout autant que l'équation de la réaction de titrage que tu avais déterminée plus haut