Inscription / Connexion Nouveau Sujet
Chimie organique 
Bonsoir cher lecteur ^^
Alors alors.. J'ai un petit problème en chimie organique. Il faut dire que je ne suis pas tres doué mais mon professeur explique tellement mal ( et oui.. les anciens profs de FAC ne font pas de cours structuré et clairs  ).
).
Il nous a demander un DM a rendre à la rentrée, c'est à dire pour mardi. Mais il faut s'aider du cours.. que je n'aie pas compris. Cependant j'ai bien recopier afin qu'il soit compréhensible. Le cour se base sur une activité et il faut faire ceci : realiser l'oxydation du butanol en acide butanoique par le permanganate de potassium.. Je suis.. PERDUE !
Seule indiquation donnée : dans l'equation de la reaction finale, on doit trouver une cétone. On doit prendre exemple sur ceci ( qui est le tube 1 dans l'exercice.. il s'agit du butan-1-ol qui reagit avec du permanganate de potassium ).
Butan-1-ol : CH3-CH2-CH2-CH2-OH ----> R-CH2-OH.. Avec R représentant la premiere partie de la chaine carbonée.
Le couple du permanganate de potassium est : MnO4-/Mn2+
L'equation : MnO4- + 8H+ + 5e- = Mn2+ + 4H20
Alcool oxydé en aldéhyde :
R-CH2-OH => R - C = 0 + 2H+ + 2e-
!
H
MnO4- + 8H+ + 5e- = Mn2+ + 4H20 ( x 2)
R-CH2-OH => R - C = 0 + 2H+ + 2e- ( x 5)
!
H
On additione et on obtient :
H
!
5R-CH2-OH + 2MnO4- + 16H+ -> R - C = 0 [/sup] + 10H+ + 2Mn2+ + 8H20
Est ce que dans l'equation de la reaction final on trouve de l'acide butanoique ? Je pense pas. Enfin, si je reprend tout afin de trouver dans l'equation finale ( comme demandé) une cetone :
Le butanol de formule : CH3-CH2-CH2-CH2-OH devient sous forme de cetone :
CH3 + C - CH2 - CH2 - CH3
//
O
Mais j'arrive pas a repartir comme dans l'exemple.. avec le R etc.. c'est bcp trop compliqué pour moi.. Enfin je suppose que tout ceci doit etre vraiment compliqué.. Mais tout ce que jespere savoir c'est la reaction finale de l'oxydation de butanol par le permanganate de potassium avec une cetone dans la reaction finale, comme on a une aldehyde dans l'exemple precedent.
Merci d'avance.

(Rhoo :p ils sont super les profs de Fac ! Enfin pas tous, certes -_-')
Bonsoir !
Tout d'abord bonne chance c'est le type d'exercice qui peut tomber le jour du bac, il n'a rien de compliqué si tu t'entraînes 
R c'est tout simplement une chaîne carbonée. Par exemple CH3 ou encore CH3CH2CH2CH2CH2CH2CH3... Ca peut aller très loin !
L'important c'est ce qu'il y a au bout, la fonction hydroxy (-OH) qui donne le nom au composé : c'est un alcool.
Butan-1-ol : CH3-CH2-CH2-CH2-OH ----> R-CH2-OH.. Avec R représentant la premiere partie de la chaine carbonée.
Ici, R désigne donc CH3-CH2-CH2-

Pour les demi-équations, il doit y avoir autant d'électrons pour l'oxydant que pour le réducteur (comme pour toutes les réactions d'oxydo-réduction...).
C'est pour cela que les demi-équations sont multipliées .
Tout l'exemple est fait à partir d'un carbone primaire, on obtient donc logiquement un aldéhyde (RCHO). Mais on peut obtenir un acide carboxylique si l'oxydant est en excès. Pour faire "simple", il y a tellement d'oxygène que le produit final est un acide (RCOOH).
Pour obtenir une cétone, le modèle est le même.
Rappel : une cétone a pour formule ROR' : la groupe '=O' est donc en plein milieu de la chaîne.
Pour pouvoir oxyder un alcool en cétone, il te faut un alcool secondaire à la base. C'est à dire que le groupement -OH est lié à un carbone lui-même lié à deux autres carbones. Ainsi le -OH ne sera pas en bout de chaîne.
Le butanol a quelques isomères, dont un est un alcool secondaire. J'ai pas trop compris comment se formule ton énoncé mais c'est un alcool secondaire qu'il faut utiliser si tu veux une cétone à l'arrivée

Jai bien relu l'enoncé de l'activité sur laquelle se base le cours. Et il y a le butan-2-ol et le 2-methylpropan-2-ol mais ca ne m'aide pas plus. J'espere que tu pourras m'aider car je galere vraiment 
En ce qui concerne les profs de fac, la pluspart de mes profs sont des profs de fac refoulés dans le privé et croit moi.. un cour structuré je ne connais pas à quoi ca ressemble ! 
Mercii beaucoup 
PS : J'ai regardé un peu sur le web les resultats qu'on trouvait pour les opxydations, mais rien de concrets que je comprenne. :S
J'ai vu que l'oxydation donnait aussi un aldéhyde comme un cétone. Enfin xP
Merci encore.. je me mettrai à genou pour que tu m'aide.. Les vacances touchent à leurs fin et j'ai pas la tete à bosser 3 jours sur ce probleme de chimie.. :S !
Si j'ai bien compris, tu as des exemples d'oxydation sur des alcool et ce que tu veux pour ton exercice, c'est réaliser l'oxydation du butanol pour obtenir une cétone...
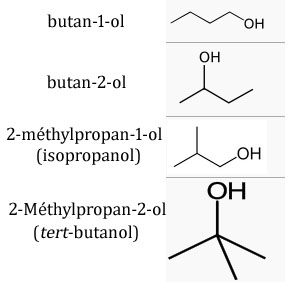
C'est pas très compliqué, pour ce qui est du butanol. C'est un composé de formule brute C4H10O. Il possède des isomères, exactement 4 (jtai fait les dessins en bas du post) :
- le butan-1-ol --> alcool primaire.
- le butan-2-ol. --> alcool secondaire.
- le 2-méthylpropan-1-ol. --> alcool primaire.
- le 2-méthylpropan-2-ol. --> alcool tertiaire.
Remarque : un alcool tertiaire ne peut pas être oxydé avec du permanganate de potassium, qui est un oxydant. La seule manière c'est de le brûler mais il reste plus rien ^^.
Quant tu utilises du permanganate de potassium sur un alcool, tu réalises ce qu'on appelle une oxydation ménagée.
Le principe est simple : l'oxydant s'attaque au groupement "hydroxy" (-OH) caractéristique de l'alcool, et ce pour former dans le cas le plus général une double liaison C=O.
Logiquement, si tu remplaces la fonction -OH sur un alcool primaire, tu obtiens un aldéhyde (RHO). Si tu remplaces la fonction -OH sur un alcool secondaire, tu obtiens une cétone (ROR'). Pour ce qui est de l'alcool tertiaire, aucune oxydation ménagée n'est possible !
Remarque : si on y va un peu fort sur un alcool primaire, par excès de permanganate de potassium par exemple, on aboutit à un acide carboxylique (RCOOH) !
Ca t'éclaire un peu ? Qu'est-ce que tu comprends pas ? ^^
Dieu existe xD J'ai prier dieu pour que je puisse avoir des explications clairs.. et merci j'ai enfin compris ce que tu as ecris !! Eh oui comme quoi les miracles arrivent. Moi en cours :  Monsieur ca veut dire quoi ca? et ceci ? Pfou je comprends riien.. ! Enfin j'en passe des meilleures et des pas mures xP!
Monsieur ca veut dire quoi ca? et ceci ? Pfou je comprends riien.. ! Enfin j'en passe des meilleures et des pas mures xP!
Alors, pour entamer l'exercice si je comprend bien, le butanol doit etre present sous la forme d'une cetone, c'est
Je ne sais pas si tu es patient, mais si tu ne l'es pas, essaie de me donner vaguement les pistes pour que jy arrive.. Je compte pas redoubler ma premiere S.. enfin je pense pas que je redoublerai.. je suis assez conscienceuse et si je comprend pas encore, je reviendrai sur le forum pour plus d'explications. Mais si tu as la patience de tout m'expliquer.. je ne saurais commencer te remercier xP
Non lol le butanol fait partie de la famille des alcools.
Au final par contre, tu veux avoir un composé de la famille des cétones : c'est celui que tu as indiqué oui :
CH3-C-CH2-CH3
||
O Ca c'est le butan-2-one ou tout simplement butanone.
Au départ tu dois donc oxyder le butan-2-ol, tout simplement =) :
CH3-C-CH2-CH3
|
OH
Tu y arrives pour les demi-équations ? C'est le même principe que dans le tube, je te laisse essayer.
Alors, pour la demie equation du permanganate, pas de soucis :
MnO4- + 8H+ + 5e- = 4H20 + Mn2+
En ce qui concerne le butan 2 ol, on va improviser xP
CH3-C-CH2-CH3 j'aurai dit qqchose qui se presente sous la forme R1-C- R2 enfin.. je ne sais pas xP ALERTE!
| |
OH OH
J'ai vu sur ton profil que tu habitais marseille xP J'habite pas tres loin ahah 
J'ai vu sur ton profil que tu étais du mois de Mars aussi 
Jvoulais te MP mais on peut pas sur ce site o_o mdr.
Bref !,
Pour la demi-équation du permanganate de potassium, c'est parfait 
Et oui pour le butan-2-ol, ça se présente sous la forme de R-CHOH-R'.
Tu as le droit de mettre CH3-CHOH-CH2-CH3 dans l'équation.
A toi de savoir l'équilibrer, le produit final est CH3-CO-CH2-CH3. Tu n'as plus qu'à mettre le bon nombre d'électrons et de protons.
Après tu peux combiner les deux demi-équations en faisant bien attention à ce qu'il y ait autant d'électrons pour l'oxydant que pour le réducteur, comme dans l'exemple.
lol je ne suis pas encore au language texto-ilephysique.. c'est quoi MP ? xP
Ahh toi aussi tu es du moi de mars xP lol.. je suppose que tu n'es pas né en fin de moi ahah xP je connais personne -_-' Je me sens seule au monde à etre née dans ces zones.. Enfin ! Ma vie et moi ca fait 2.. je suis pas marseillaise mais je parle et je parle ( principalement pour rien dire mais ca du a du le remarquer.. xP ) !!
Ohh pour une fois que quelqun me dit 'parfait'.. je crois que je vais imprimer la page et lencadrer ds ma chambre.. Ca changera des 'peux mieux faire' ! Enfin! Bref comme tu dis, pour revenir a nos moutons..
CH3-CHOH-CH2-CH3 = CH3-CO-CH2-CH3 + 2H[sup]+/sup] + 2e[sup]-/sup] ???
mercii 
Euh MP c'est message privé !
C'était pour te dire que oui j'avais la patience pour tout t'expliquer lol. Mais bon on peut pas, y'a que l'affichage des adresses e-mail, j'en ai profité pour rajouter l'affichage de la mienne ^^
M'enfin c'est nul qu'on puisse pas MP.
Sinon c'est ça, deux électrons e- et deux protons H+.
Maintenant combine les deux demi-équations en enlevant les électrons 
Il se trouve que c'est exactement pareil que tout à l'heure (normal puisqu'on à affaire à deux isomères) : x2 et x5.
2Mn04- + 11H+ + 5CH3-CHOH-CH2-CH3 --> 2MN2+ + 5CH3-CO-CH2-CH3 apres reduction des H+ et des electrons.
Voili voilouuu 
On vient a peine de commencer la chimie orga xP Je crois que j'aurai besoin de ton aide !( eventuellment .. enfin quand je dis ca.. CEST SUR lol)
Si tu veux bien je peux prendre ton adress mail pour tenvoyer des MPs ( wesh sa language ilephysique.. lol desolé je memporte un peu. je crois que le jus de pomme a de mauvaise influences.. :S ! )
Sans vouloir etre trop indiscrete.. ca se passe bien la TS et ta pris quelle specialité ? Le bac approoche ( bon tinkiete je vais pas te faire stresser.. je suis sure que tu vas assurer avec tes talents en chimie  )
)
Je vais devoir te laisser bientot pour aller faire dodo.. tu dois de dire : si tot en vacances ?? Eh bien.. je suis en plein deménagement! Coup de bol avec mon ordi acheté recemment jai pu capter la connection internet wifi du voisin du palier du dessus et avoir internet sur mon ordi portable.. sans sa, mon dm de physique je l'aurai rendu sur une feuille blanche.. xP ( enfin quand meme pas mais presque  )
)
Bonne soirée.. si tu veux, je t'envoie rapido un MP ( lol desolée je me prend de ces fou rire sur ce racourci de message perso  enfin.. ) comme ca tu a mon adresse aussi ( comme ca tu ne seras pas : qui sais cette fille ? quand tu recevras un MP de moi xP )
enfin.. ) comme ca tu a mon adresse aussi ( comme ca tu ne seras pas : qui sais cette fille ? quand tu recevras un MP de moi xP )
Bsx! Clo'
ops.. en lisant tes infos perso, je me suis rendu compte que la terminale c'etait fini pour toi ? Pharmaciie ? Oh bon dieu c'est ce que je veux faire -_-'! Mais bon , vu mon niveau en chimie orga.. je suis loin d'y arriver!
14 mars.. coicidence.. 14 + 14 = 28 --> ma date de naissance.. lol enfin.. je suis un peu bizaaarrree 
Bonne soirééé Whiskas... je ne connais pas ton nom dc euh.. ben ce sera whiskas.. comme la marque de croquette pour mon chat ( au feminin.. jallais pas dire... ou ca allait porter a confusion xP )
Pas de problèmes mais tu peux pas me MP justement c'est pas possible.
Ajoute mon adresse si tu veux tout savoir sur la TS lol.
Je ne crois pas que les modérateurs apprécieront si ça se transforme en forum de discussion ^^
Kiz'x.


