Inscription / Connexion Nouveau Sujet
Caculer quantité de Co2 a partir de pression, T° et volume
Salut à tous,
J'ai un petit problème avec une question de mon devoir. Il s'agit de trouver une quantité de Co2 a partir d'une pression.
L'énoncé est le suivant :
Dans un ballon de 1L, on verse V=60,0mL d'une solution d'acide éthanoïque de concentration c=1,00 mol/L.
On y introduit rapidement une masse m = 1,25 g d'hydrogènocarbonate de sodium NaHCO3. On ferme hermétiquement le ballon à l'aide d'un bouchon muni d'un tube à dégagement relié à un capteur différentiel de pression.
L'acide éthanoïque réagit sur l'ion hydrogénocarbonate suivant la réaction :
CH3CO2H(aq) + HCO-3 (aq) ---> CO2(g)+ H2O(l) + CH3CO-2(aq).
On relève la pression du dioxyde de carbone dégagé dans le ballon en fonction du temps. On obtient le graphique ci-après.
La question est :
Déterminer a l'aide du graphique la quantité de dioxyde de carbone en fin d'experience, la température est de 25°C et le volume du ballon étant de 1.35 L.
Merci d'avance a celui qui voudrais bien m'aider. (je voudrais juste la méthode pour comprendre)
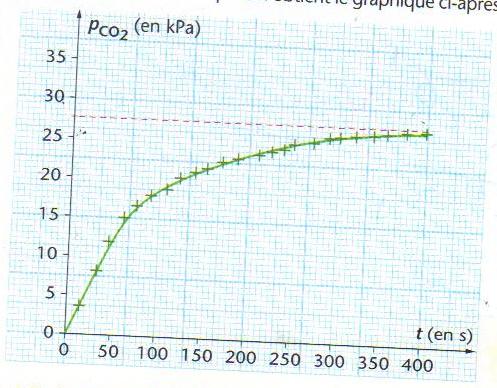
Je suppose que le volume du ballon est de 1,35 litres (différent de la donnée du début de l'exercice ???)
Le CO2 va occuper la totalité des 1,35 litres (au volume négligeable des composant liquides près)
PV = nRT
27,5.10^3 * 1,35.10^-3 = n * 8,31 * (273 + 25)
n = 0,015 mol
En fin d'expérience, il y a 0,015 mol de dioxyde de carbone.
-------------
On peut le vérifier (mais ce n'est pas demandé) par réflexion à partir de la réaction chimique.
Je le fait :
Quantité de matière de CH3CO2H(aq) versée dans le flacon : n = 0,06
Masse molaire du NaHCO3 : 23 + 1 + 12 + 3*16 = 84 g/mol
1,25 g de NaHCO3 : n = 1,25/84 = 0,015 mol
Le réactif limitant est donc le HCO3-
D'après la réaction chimique donnée et les calculs ci-dessus, la quantité de matière de CO2 produit par la réaction sera de 0,015 mol.
Cela confirme donc le résultat trouvé.
-----
Sauf distraction. 
Merci,
En ce qui concerne l'orthographe, moi aussi je m'en excuse d'avance . 
Sinon dans ta 2è explication tu répond un peu a la question suivante et je crois que je m'en suis bien sorti.
Question : II-a/ Calculer la quantité initial de réactifs. Quel est le réactif limitant ?
J'ai fait : n= m/M soit n= 1.25/84.0 n= 0.01 mol (dans l'énoncé j'ai 3 chiffres significatifs je suis donc obligé de m'arrêter aux centièmes ?)
Question : b/ dresser le tableau d'évolution de la transformation. Calculer l'avancement maximal.
Et la je bloque car je n'arrive pas a faire le tableau d'avancement.
Je crois comprendre que les 2 réactif sont Acide éthanoique c-a-d CH3CO2H et Hydrocarbonate de sodium c-a-d NAHCO3 mais ce dernier n'apparait pas dans l'équation.
Ça m'a l' ère compliqué mais j'ai le pressentiment que non.
Merci de bien vouloir m'aider
Attention, n = 0,01 mol ne possède pas 3 chiffres significatifs.
n = 1,25/84,0 = 0,0149 mol, là, il y a 3 chiffres significatifs.
-----
Avancement maximal
0,0600 CH3CO2H(aq) + 0,0149 HCO-3 (aq) ---> 0,0149 CO2(g)+ 0,0149 H2O(l) + 0,0149 CH3CO-2(aq) + 0,0451 CH3CO2H
-----
Sauf distraction. 
Attention, mon équation finale est bancale.
Attend plutôt quelqu'un à l'aise en chimie (et donc pas moi)

en effet,l'équation ne doit comporter que les coef stoechiométriques.
Chacun son truc!(bien que la présentation du tableau d'avancement me pose problème dans certains cas (dosages),car je n'ai pas beaucoup utilisé ce système)
CH3COOH HCO3- CH3COO- CO2 H2O
état initial 0,0600 0,0149 0 0 0
en mol
àl'instant t 0,0600-x 0,0149-x x x x
état final 0,0451 0 0,0149 0,0149 0,0149
l'ion Na+ est spectateur ;il n'est pas utile de le faire figurer dans le bilan
à propos des chiffres significatifs:dans cet énoncé ,les concentrations et volumes sont donnés avec 3 chiffres significatifs.Il serait logique d'exprimer les masses molaires avec 3 chiffres significatifs.
Merci a toi coriolan cependant si Na+ est spectateur pourquoi dans la colonne de HCO3- on doit trouver l'état initial 0.020 mol.
Je ne dit pas que tu as tort mais je voudrai comprendre pourquoi il faut dans le calcule de n(HCO3-) ?
Merci d'avance en espérant que ma question est compréhensible.
d°/ comparer avec le résultat expérimental. Conclure
Ils sont tout les 2 identiques mais je ne vois pas quel conclusion en tirer
bonjour,
tu n'a copié qu'une partie de l'énoncé ,si bien que je ne sais pas à quoi correspondent les questions c et d.
Pourquoi devrait-on trouver n(HCO3)initial =0,020mol?
Le calcul de JP est bon.
n(NaHCO3)=1,25/84=0,015 mol
NaHCO3 se dissocie en HCO3- et Na+ ;donc n(HCO3-)=0,015 mol
n'aurais-tu pas calculé
n(HCO3-)=1,25/61=0,020 mol ? ;ce qui est faux.
C'est ce que j'avais fais n(HCO3-) qui a priori est faux.
Merci, je tacherai de m'en souvenir à l'avenir.
Pour résumé, il y à 2 grandes partis
- Dans la première on me demande de calculer la quantité de CO2 dégagé en fin d'exp. en s'aidant du graphique (scanné plus haut).
J'ai trouver qu'en fin d'exp. il y avait 0,0149 mol
- Dans la 2nd partie on me demande de comparer la valeur trouver en expérience et celle trouver dans le tableau d'avancement.
Le résultat est le même, je voudrais savoir si il sagit de calculer l'écart en % entre la valeur expérimental et la valeur théorique et conclure par le pourcentage de différence.
Est-ce bien ce qui est demandé ?
si les résultats sont identiques ,un calcul d'erreur relative n'a pas d'intéret.
on peut ,par exemple ,dire que les mesures vérifient que la réaction est totale


