Inscription / Connexion Nouveau Sujet
Bilan de matière d'une transformation chimique
Bonjour à tous,
Je suis acctuellement sur un exercice où je bloque vraiment.
J'aimerais si possible avoir un petit coup de pouce afin de m'éclaircir.
Voici l'énnoncé :
Dans un bécher se trouve 20.0 mL d'une solution de sulfate de cuivre telle que [Cu2+]= 0.50 mol/L.
On dispose aussi de soude telle que [OH-]= 1.0 mol/L.
1/ Quel volume de soude faudrait-il verser pour produire 0.50g de Cu(OH)2 ?
2/ Quelle masse maximale de Cu(OH)2 pourrait-on produire ?
3/ Quel volume minimal de soude faudrait-il verser pour cela ?
Je suis sur que l'exercice n'est pas si compliqué que ça mais j'aurais vraiment besoin d'une petite aide 
Merci
Bonjour Kaela,
En fait, nous avons pas encore appris ce qu'était un tableau d'avancement.
Simplement, on a vu cette équation : Cu2+ + 2OH- ---> Cu(OH)2
Bonjour !
Je n'ai pas encore abordé ce chapitre, mais puisque toi oui, est-ce que tu as dans ton cours une formule pour savoir la quantité de matière obtenue quand tu sais combien de moles de chaque réactif tu as utilisé ? Par exemple
1mol de Cu2+ + 2mol de OH-  x mol de Cu(OH)2
x mol de Cu(OH)2
ah, grâce au topic 239168 (![]() Avancement d'une reaction chimique), je crois avoir à peu près compris
Avancement d'une reaction chimique), je crois avoir à peu près compris 
Tu dois d'abord répondre aux questions suivantes:
a)Quelle équation chimique traduit cette transformation? => déjà fait
b)Déterminer les masses molaire des reactifs.
c)Calculer la quantité de matière initiale de sulfate de cuivre
Je t'enverrai la suite plus tard 
re : Avancement d'une reaction chimique Posté le 22-04-10 à 11:07
Posté par gbm
On réalise le broyage d'un mortier, de 1,0g de nitrate de plomb, Pb(NO3)2, avec 1,0g d'iodure de potassium KI.
1. Enoncé de l'exercice
a)Quelle équation chimique traduit cette transformation?
b)Déterminer les masses molaire des reactifs?
c)Etablir un tableau d'avancement pour cette reaction chimique.
d)En deduire le réactif limitant de cette reaction chimique.
e)Calculer la masse de chaque produit formé.
2. Solution de l'exercice
a. L'équation de la réaction est Pb(NO3)2 + 2KI ----> PbI2 +2KNO3
b. Calculons les masses molaires des réactifs :
M(KI) = M(K) + M(I) = 166 g/mol
M(Pb(NO3)2) = M(Pb) + 2M(N) + 6M(O) = 331,2 g/mol
c. Calculons d'abord les quantités de matières initiales des réactifs (à t=0) :
ni(KI) = m/M(KI) = 1,0 / 166 = 0,00602 mol
ni(Pb(NO3)2) = m/M(Pb(NO3)2) = 1,0 / 331,2 = 0,00302 mol
On remplit le tableau d'avancement suivant :
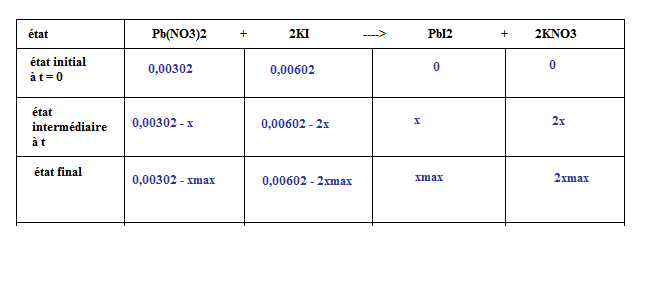
d. A l'état maximal, tous les réactifs ont réagi, leurs quantités de matière sont nulles :
0,00302 - xmax = 0 <=> xmax = 0,00302 mol
0,00602 - 2xmax = 0 <=> xmax = 0,00301 mol
on choisit le plus petit des xmax donc xmax = 0,00301 mol --> KI est le réactif limitant
Donc, à l'état final, nf(PbI2) = xmax = 0,00301 mol.
e.On peut déterminer la masse de PbI2 apparue par m(PbI2) = nf(PI2).M(PbI2)
avec M(PbI2) = M(Pb) + 2M(I) = 461 g/mol
donc m(PbI2) = 0,00301*461 = 1,39 g de PbI2 formé.
Tu dois d'abord répondre aux questions suivantes:
a)Quelle équation chimique traduit cette transformation? => déjà fait
b)Déterminer les masses molaire des reactifs.
c)Calculer la quantité de matière initiale de sulfate de cuivre
Je t'enverrai la suite plus tard

Bonjour Pavlina !
Merci pour ton aide. Je pense avoir a peu près compris. Si je m'en tiends à ce que tu m'as dis je devrais déjà trouver les masses molaires des réactifs utilisés :
2 ) - M(Cu2+) = 63.5 g/mol
- M(OH-) = 16.0 + 1.0 = 17.0 g/mol
3 ) Maintenant il faut donc que je traouve la quantité de matière initiale du sulfate de cuivre : Or je n'ai pas ma masse (m) mais le Volume 20mL , la concentration 0.50mol/L et maintenant la masse molaire 63.5g/mol du sulfate de cuivre .. Or si je fais n = C X V ceci me donnera la quantité de matière du sulfate de cuivre non ?
Alors donc en faisant n = C X V Je trouverai la solution de la quantité de matière pour l'ion cuivre ?
D'accord merci . En ayant ainsi la quantité de matière de l'ion sulfate n = C X V = 0.50 mol/L X 20mL X 10-3 = 0.01 mol , je peux maintenant trouver le volume du OH- necessaire pour former 0.50g de Cu(OH)2 ?
En ayant ainsi la quantité de matière de l'ion sulfate n = C X V = 0.50 mol/L X 20mL X 10-3 = 0.01 mol , je peux maintenant trouver le volume du OH- necessaire pour former 0.50g (=masse) de Cu(OH)2 ?
Dans un bécher se trouve 20.0 mL d'une solution de sulfate de cuivre telle que [Cu2+]= 0.50 mol/L. On dispose aussi de soude telle que [OH-]= 1.0 mol/L.
1/ Quel volume de soude faudrait-il verser pour produire 0.50g de Cu(OH)2 ?
je crois qu'il faut d'abord tout ramener à des quantités de matière :
calcule donc la masse molaire du Cu(OH)2
puis la quantité de matière équivalente à 50g de Cu(OH)2
calcule la quantité de matière de OH- nécessaire
utilise la formule C=n/V ou plutôt V=n/C pour trouver le volume de soude (et pas seulement de OH- )



