Inscription / Connexion Nouveau Sujet
Benzene --- H2SO4, HNO3 --> Nitrobenzene
Bonjour,
Est ce que quelqu'un peut m'expliquer pourquoi dans la reaction :
Benzene --- H2SO4, HNO3 --> Nitrobenzene
un proton de l'acide sulfurique est attaqué par le OH de l'acide nitrique plutôt que par un des O- "en resonance" ?
Bonjour mwa1 :
La nitration aromatique est une substitution électrophile aromatique particulière au cours de laquelle un atome d'hydrogène lié à un atome de carbone du cycle aromatique est substitué par un groupement nitro -NO2 pour former du nitrobenzène. L'électrophile utilisé pour la substitution est NO2+ (ion nitronium), produit in-situ.
Dans la pratique pour effectuer la substitution, le benzène est chauffé à 50 °C environ dans un mélange d'acide sulfurique et d'acide nitrique. Le schéma réactionnel est le suivant :
(1) 2H2SO4 + HNO3 → 2HSO4- + NO2+ + H3O+
(2) C6H6 + NO2+ → C6H5NO2 + H+
(3) H+ + H3O+ + 2HSO4- → H3O+ + H2SO4 + HSO4-
L'acide sulfurique joue en quelque sorte le rôle de catalyseur pour la formation de l'ion nitronium. La réaction est également possible avec l'acide nitrique seul, mais elle est alors beaucoup plus lente. Parmi les autres réactifs utilisables pour la nitration aromatique, on peut citer le tétrafluoroborate de nitronium, qui est un sel de nitronium obtenu à partir de fluorure d'hydrogène, d'acide nitrique et de trifluorure de bore.
Ne pouvant pas dessiner les structures chimiques, regarde le méchanisme sur Google ( substitution électrophile aromatique, nitration du benzène ) .
Bonnes salutations .
Oui, je connais le mécanisme mais je ne comprends pas pourquoi ça se passe comme ça.
D'abord l'acide sulfurique cède un proton et l'acide nitrique va agir comme une base et capter ce proton puis se disocier en NO2+ + H2O
mais je ne comprends pas pourquoi c'est l'hydroxyle de l'acide nitrique qui attaque le proton alors que de l'autre côté de la molécule il ya des oxygènes chargés négativement (alternativement par résonance) et on aurait quelque chose comme ça :
( désolé si je blasphème, j'ai pas fait beaucoup de chimie  )
)
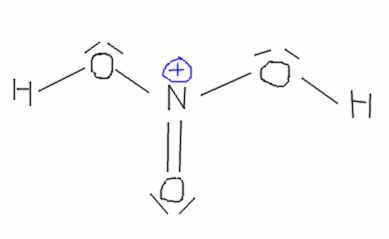
Je n'ai pas trouvé une explication claire , mais je pense qu'il se forme une condensation du proton acide sulfurique avec le -OH de l'acide nitrique qui va former
l'acide nitrosylsulfurique HO-SO2-O-NO2 qui à son tour forme le cation NO2+ et HSO4- et H2O .
Regarde sur Google formation de l'acide nitrosylsulfurique . Tiens -moi au courant .


