Inscription / Connexion Nouveau Sujet
2,2 dimétyl butane
Bonsoir!!
Je ne sais pas comment construire la forrmule semi-developpée du 2,2 -Diméthyl butane .. Pourriez-vous m'aidez svp???
Je sais faire les schémas de Lewis (je pense ^^) mais.. dyméthyl c'est quoi? c'est 2 métyl?? Le méthyl vient du méthane??
Svp
merci
lunie
Merci..
Mais le méthyl à un rapport avec l'éthane?
J'ai écris ça dans on cours, mais je ne le comprends pas :
C2H6 éTANE ---- (Substituant) Méthyl
:/
pardon je me trompe de ligne ^^
ch4 Méthane -- (subsituant) Méthyl
Le méthyl c'est Ch3 et le diméthyl 2 ch3 . ok
Quelle est la différence entre le méthane et méthyl?
Je vois pas trop comment représenter..
Il y a la fois du dimétyl+butane...
Svp, Merci
oulah une question à la fois...
Le 2,2 cela signifie que le substituant (ici le méthyl) est placé 2 fois sur le carbone n°2 (on numérote en fonction de la fonction principale de la molécule)
Le méthane est une molécule à part entière : CH4
Le méthyl est un groupement : c'est un bout de molécule.
ex: 2 méthylpropane s'ecrit : CH3-CH-CH3
CH3
Merci Lulu3324
j'ai encore du mal à tout comprendre, désolé
Le propane sécrit C3H8
Le méthyl s'écrit CH3
Le propane : CH3-CH2-CH3
2 métyl propane : Cela signifie qu'il y a du méthyl lié au carbone numéro 2.
CH3-CH2-CH3
CH3
Pourquoi c'est CH??? (à la place où moi j'ai mis CH2 ? )
Merci
Lunie
Parce que ton carbone (comme tous les carbones d'ailleurs) ne peut faire que 4 liaisons maximum autour de lui. Si tu mets CH2 combien fait-il de liaisons?
ok, Merci! 
Cela existe le :
2 Diéthyl hexane par exemple?
Je dois donner d'autres exemples de molécules ( comme 2,2 diméthyl butane.. )
Il y a aussi qq que je ne comprends pas: LA représentation des molécules dans l'espaces.. Cram
Je vous remercie
Bonne soirée!!
Lunie
Pour le 2,2-diméthylhexane : il existe mais d'après la nomentclature officiel il ne s'appelle pas comme cela mais plutot : 3-éthyl-3-méthylheptane (si je ne trompe pas...). Il a pour fomule développée :
Pour la représentation de Cram c'est facile (il faut la voir en perspective): il y a, dans le cas précédent :
=> 2 liaisons dans le plan (représentée par un trait simple)
=> 1 liaison qui vient vers l'avant du plan (représentée par un petit traingle noir)
=> 1 liaison qui va vers l'arrière du plan (représentée par des pointillés)
Si tu as du mal a voir ca dis toi que cette molécule, si on pouvait la tenir dans la main, elle reposerait sur la table par ces 3 pieds (les 3 liaisons du bas) et on pourrait la tenir en l'air par la liaison du haut...
ca t'aide?
Merci Lulu! 
Pour le 2,2-diméthylhexane :
Je ne comprends pas. Le méthyl s'écrit CH3, il y a deux CH3 sur la "deuxième chaîne. D'où viennent les deux "CH2"??
J'arrive à faire les représentations de Lewis pour les molécules simples
ex : Méthane,hexane, HCL .. Mais les molécules comme le diméthylhexane.; J'ai plus de mal. Pourriez-vous me donnez 2/3 autres molécules de ce style pour que je m'entraine .. ? Merci.
Pour la représentation de Cram.. Comment savoir si les liaisons sont dans le plans, avant du plan, arrière??
Je ne vois pas trop comment "voir".. Est-ce que cela difère selon les molécules..?
dans l'odre de tes questions :
le CH2 provient du fait que tu voulais représenter le 2,2 diéthylhexane. Le groupement éthyl s'écrit -CH2-CH3.
Pour Lewis : c'est la meme chose que pour le méthane ou l'hexane !!
autres exemple : H2O, CO2, CH3-OH, CH3-COOH
Pour Cram : tout dépend de ce qu'on te demande de représenter. Mais il me semble que ca depasse ton programme tout ca non?
Bonjour! 
Dans mon cours, j'ai représenté le 2,2 diméthyl hexane, le 2 méthyl propane et le 3,4 diméthyl hexane. Mais ces 3 molécules ont des isomères?
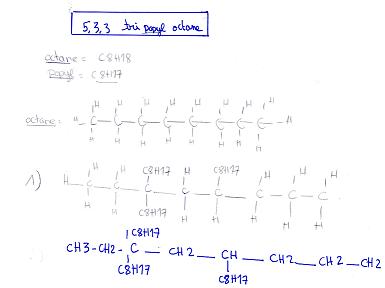
Le 5,3 tétrapropyl propane existe? Pour que j'essaye de le représenter...
H20 et C02 : je sais le représenter
par contre CH3-OH et CH3-COOH :/
Le trait représente une liaison covalente? Donc je représente déjà CH3 et ensuite OH .?
Il faut que je sois capable de représenter les isomères d'une molécule..
Pour C6H14, ça c'est de l'hexane
CH3-CH2-CH2-Ch2-Ch2-Ch3
Mais maitenant comment savoir quels sont ces isomères?
Pour la représentation de Cram.. J'ai juste vu qu'un trait plein = liaison dans le plan, qu'un triangle hachuré = liaison en arrière du pla, et triangle plein : Liaison en avant du plan. Mais.. Comment svoir ? :/ dsl..
Je vous remercie
Lunie
là aussi je vais essayé de répondre dans l'ordre (beaucoup de questions!!)
Ce sont dejà des isomères les uns des autres !!
Le 5,3tétrapropylpropane ne peut pas exister car le propane ne comporte que 3 carbones !!! comment mettre un propyl sur le 5e carbone ?!!!!! Essaye de représenter le 5,3,3tripropyloctane...
Dans CH3-OH j'ai mis un trait d'union pour mieux voir le OH c'est tout. Sinon c'est bien une liaison covalente (comme les autres liaisons d'ailleurs)
Les isomères seront les molécules de meme formule brute mais de formule développées différentes. Exemple : isomères de CH3-CH2-CH2-OH : CH3-CH-OH, CH3-CH-CH3,...
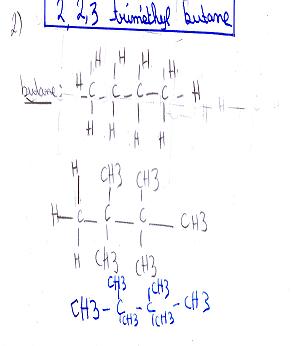
Alors , j'ai représenté le 5,3,3tripropyloctane ainsi que le 2,2,3 Triméthyl butane .
Et.. Les isomères du butane ??
J'ai trouvé :
CH2 - CH2-CH3
CH3
CH3-CH - CH3
CH3
je vous remercie
isomères de CH3-CH2-CH2-OH : CH3-CH-OH, CH3-CH-CH3,...
euh je ne comprends pas :/
CH3-CH-OH, déjà cette molécule contient 2 carbones alors qu'il en faudrait 3?
Pour la 1ere molécule (5,5,3...etc) :
- le propyl c'est -CH2-CH2-CH3 soit C3H7 !
- Tu as oublié un H sur le dernier carbone (le 8e) pour faire CH3 !
rappel : méthyl :CH3
éthyl: -CH2-CH3
propyl: -CH2-CH2-CH3
butyl: -CH2-CH2-CH2-CH3
pentyl: -CH2-CH2-CH2-CH2-CH3
hexyl: -CH2-CH2-CH2-CH2-CH2-CH3
Pour la 2eme molécule :
- Tu as un CH3 en trop : la chaine principale (butane) est horizontale et tu as mis 4 CH3 alors que, d'après la formule semi-developpée, il n'y en a que 3 !!
Pour les exemples d'isomères je me suis emmelé les pinceaux : c'est faux !!
Je reprends donc : isomères de CH3-CH2-CH2-OH : CH3-CHOH-CH3, CH3-CH-OH
CH3
Merci Lulu!!!!
Bon, j'ai refait, j'espère ne pas avoir encore fait de fautes vu que je vais assez vite.
ok, je regarde si je comprends les isomères de CH3-CH2-CH2-OH .
Sinon, vous savez pour la représentation des molécules géométriquement.. Les doublets liants... Comment on les place?? Sur un schéma de Lewiq, cela n'a pas d'importance mais pour Cram..
J'ai lu qu'ils fallaient écartés les atomes le plus possible "Repulsion"...
Puis, le doublet qui vient vers moi c'est forcément une liason dans le plan.. Mais pour les autres..?
désolé ne poser autant de questions. De toute façon mon DS est dans longtemps (une semaine environ) donc c'est pas très très urgent. 
JE vous remercie
Lunie.
Alors pour les isomères de CH3-CH2-CH2-OH
Je comprends le 2ème mais pour le premier, je n'arrive pas à faire la représentation de Lewis pour le groupe CHOH.
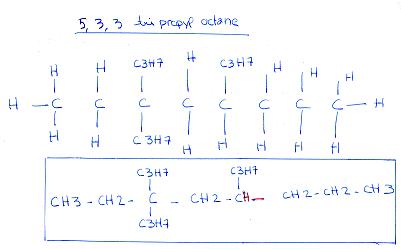
Pour le 5,3,3 c'est juste !!
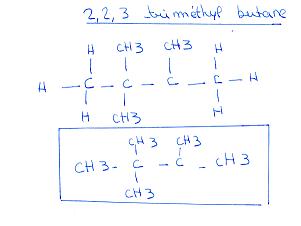
Pour le 2,2,3 il te manque un H car le carbone n°3 n'a que 3 liaisons. Il faut qu'il en ait 4 !!
Figure de répulsion pour la molécule de NH3 :
Je comprends pas quand tu dis : "le doublet qui vient vers moi c'est forcément une liaison dans le plan" : non !! si il vient vers toi il n'est pas dans le plan...
Bonsoir Lulu!
Merci, oui j'ai oublié un doublet pour la représentation de Lewis
"le doublet qui vient vers moi c'est forcément une liaison dans le plan"
Faute de ma part, " c'est forcément une liasion.. du 1er plan donc triangle colorié
Alors pour la représentation de Cram, ce n'est pas clair pour moi..
A partir de Lewis,
-
-H-N-H
H
Comment faire? Comment savoir positioner mes doublets liants?
Je pense savoir placer la liasion du 1er plan, mais les autres??
JE vous remercie
De toutes façon mes doublets non liants, je les représente tout le temps dans "le plan" non? Càd par un trait simple.
C'est mes doublets liants que je vais représentés par un triangle coloré ou hachuré ou en trait droit.
Prenons l'exemple du méthane :
A partir de la représentation de Lewis, comment disposés mes doublets LIANTS pour Cram?
DSl je pose tjs les mêmes questions :/
Pour le méthane pas de pbl vu que la molécule est symétrique. Mais pour une molécule qui n'est pas symétrique tout dépend de ce qu'on te demande de représenter (mais je ne sais pas si ces règles de représentation sont à ton programme)
non je ne pense pas que ce soit au programme
dans mon cours j'ai juste fait la représentation de deux molécules, rien de plus.. C'est pour ça que je me pose certaines questions...:/
Le prof a fait les doublets liants "comme ça" mais je me demande pk ils sont placés de cete façon.??
Par ex, C02
Les 4 doublets liants sont dans le même plan??
Oui car la molécule ne comporte que 3 atomes... donc ca sera toujours dans le plan...
Connais-tu la formule de Lewis du CO2?
Oui, je connais la formule de Lewis du CO2
O - C - O
Il ya deux liaisons entre l'oxygène et le carbone..
lewis, ça va c'est pour cram...


