Inscription / Connexion Nouveau Sujet
Les forces intermoléculaires
Bonjour,
Je dois rendre cette activité dans deux jours, mais j'ai pas fini d'achever tout (enfin le tout de l'activité est partiellement achevé). Voici l'activité ainsi que mes réponses à corriger ou m'aider :
Comparer les températures de fusion de certains solides permet de comprendre les forces intermoléculaires mises en jeu.
Etude de documents
1) Evolution de la température de fusion
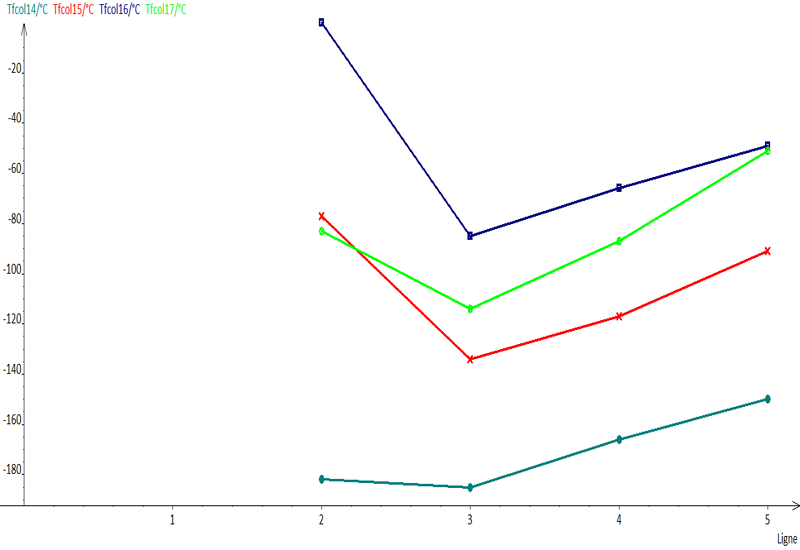
On considère les éléments des lignes 2 à 5 de la classification périodique, contenus dans les colonnes 14 à 17. Tous ces éléments peuvent former des molécules avec l'hydrogène. La température de fusion des espèces chimiques correspondantes est donnée dans le tableau ci-dessous.
| Colonne | Ligne | Composé | Température de fusion (°C) |
| 14 | 2 | CH4 | -182 |
| 3 | SiH4 | -185 | |
| 4 | GeH4 | -166 | |
| 5 | SnH4 | -150 | |
| 15 | 2 | NH3 | -77 |
| 3 | PH3 | -134 | |
| 4 | AsH3 | -117 | |
| 5 | SbH3 | -91 | |
| 16 | 2 | H2O | 0 |
| 3 | H2S | -85 | |
| 4 | H2Se | -66 | |
| 5 | H2Te | -49 | |
| 17 | 2 | HF | -83 |
| 3 | HCl | -114 | |
| 4 | HBr | -87 | |
| 5 | Hl | -51 |
2) Les forces de Van der Waals
Johannes Diederik van der Waals, physicien néerlandais (1837 - 1923), a réalisé des recherches relatives aux interactions entre les molécules au sein des gaz. Il a obtenu le prix Nobel de physique en 1910 pour ses travaux sur les forces de cohésion à courte distance.
Au sein de la matière, les nuages électroniques exercent les uns sur les autres des interactions électromagnétiques. Ces interactions ont été nommées interactions de van der Waals en son honneur.
3) La liaison hydrogène
Dans les composés comportant des liaisons O ___ H, N ____ H et F ____ H,
il y a possibilité d'établir une " liaison hydrogène" entre un atome d'hydrogène lié à un atome O, N ou F et un autre atome O, N ou F. On représente cette liaison par des pointillés entre l'atome d'hydrogène et l'atome O, N ou F avec lequel il n'ya pas de liaison covalente.
Et les questions :
1)
a) Sur un même graphique, tracer les courbes donnant, pour une même colonne, l'évolution de la température de fusion des composés en fonction du numéro de la ligne.
b) Décrire l'évolution des températures de fusion observée.
2)
a) De quel type sont les interactions de van der Waals ? A quoi sont-elles dues ?
b) Comment évoluent ces interactions entre les molécules lorsqu'on évolue de la ligne 3 à la ligne 5 du tableau périodique ?
3)
Que dire de la température de fusion des composés de l'hydrogène de la ligne 2 par rapport aux autres composés ?
4)
a) Ecrire les formules développées des molécules de méthane CH4, d'ammoniac NH3, d'eau H2O et de fluorure d'hydrogène HF.
b) Représenter la liaison hydrogène entre deux molécules d'eau.
c) Trouve-t-on des liaisons hydrogène entre des molécules de méthane ?
5)
a) Quelle est l'influence de la présence de liaison hydrogène sur la température de
fusion d'un solide ?
b) Justifier l'allure différente de la courbe d'évolution des températures de fusion pour les éléments de la colonne 14.
6)
Que peut-on dire de l'intensité de la liaison hydrogène par rapport aux interactions de Van der Waals ?
7)
Comment est assurée la cohésion des solides moléculaires ? Les forces de cohésion ont-elles toutes la même intensité ?
Mes réponses :
1a) Voir le graphique ci-dessous fait avec Regressi.
b) Là selon ce graphique, je peux dire que les températures de fusion de colonne 14 et 17 augmentent tandis que celui de colonne 15 et 16, ils diminuent à la troisième ligne, puis augmentent au-delà de cette ligne. (Je ne suis pas sûr si je suis bon tant que j'ai décrit selon le graphique).
2a) Les interactions de Van der Vaals sont électromagnétiques; elles sont dues aux nuages électroniques des atomes s'exerçant les uns sur les autres. (ça aussi je ne suis pas sûr et j'ai besoin beaucoup d'arguments en rapport avec cette activité pour justifier).
b) De la ligne 3 à 5, les interactions augmentent entre les molécules. (ça aussi je ne suis pas sûr et j'ai besoin beaucoup d'arguments en rapport avec cette activité pour justifier).
3) Ces composés de la ligne 2 font diminuer la température de la ligne suivante...
4a) Méthane CH4:
H
|
H-C-H
|
H
Ammoniac NH3:
H
|
H-N-H
Eau H2O:
H-O-H
Fluorure d'hydrogène HF:
H-F
b)
H-O-H---O-H
|
H
(Pourquoi cette représentation? Comme le domument me signale
entre un atome d'hydrogène lié à un atome O, N ou F et un autre atome O, N ou F.
Mais sauf que je n'en suis pas sûr si sa doit être comme ça.
c)Impossible, car seuls les atomes O, N ou F sont acceptés pour former une 'liaison hydrogène' (J'ai aussi besoin d'une terme approprié à cela). Le méthane contient en effet un atome de carbone C, ce qui ne fait pas une liaison hydrogène.
5a)L'influence de la présence de liaisons hydrogènes permet d'augmenter les températures de fusion d'un solide.
b)En terme de température de la ligne 2 à 5, la température de fusion de la colonne 14 est la plus faible (ou "froid?" car elle est négative) des autres températures de fusion.
En terme de 'croissance' (c'est comme ça qu'on dit?) au cours du temps, la température de fusion augmente strictement au-delà de la ligne 2.
6)L'intensité de la liaison hydrogène est plus forte que les interactions de Van der Vaals.
7)La cohésion des solides moléculaires est assurés par les interactions de Van der Vaals et la liaison hydrogène. Les forces de cohésion n'ont pas la même intensité (l'intensité le liaison hydrogène est supérieure aux interactions de Van der Vaals).
Voilà, vous pouvez m'aider corriger et/ou vérifier si j'ai raisonné.