Inscription / Connexion Nouveau Sujet
Equation d'oxydoréduction
Bonjour, je suis en 1ère S et c'est la première fois que je poste sur ce site en raison d'une incompréhension au niveau des équations d'oxydoréduction.
Pour écrire les demi-équations rédox je n'ai pas de soucis mais c'est pour l'équation d'oxydoréduction que j'ai quelques soucis. J'arrive à bien équilibrer, multiplier pour avoir le même nombre d'électrons mais j'ai des soucis pour l'addition des deux demi-équations rédox.
En effet, après avoir fait quelques exercices, je me rends compte que dans certains cas, on additionne Ox1 avec Ox2 et Red1 avec Red2,alors que pour d'autres, on additionne Red1 avec Ox2 et Ox1 avec Red2.
Je pensais qu'il y avait un ordre d'addition et je ne sais jamais qui additionner avec qui.
En espérant avoir été clair.
Merci d'avance 
Re-bonjour 
Ou alors aussi peut-être que cela vient du fait que je pense que l'oxydant est toujours à gauche de l'équation car je vois qu'il peut aussi être à droite même je ne comprends pas comment l'oxydant peut-être à droite.
bonjour
Ton problème vient du fait que certains écrivent les 1/2 équations dans le même sens ,c'est à dire Ox +ne- = Red
Ensuite ,il faut inverser l'une des 1/2 équations ,puisqu'on ne peut additionner une 1/2 équation de réduction qu' avec une 1/2 équation d'oxydation.(après avoir trouvé ,si nécessaire ,un multiple commun au nombre d'électrons mis en jeu dans les 2 1/2 équations)
Une réaction d'oxydo -réduction met toujours 2 couples redox en jeu.
Ox1/Red1 et Ox2/red2
La réaction naturelle entre l'oxydant le + fort des 2 couples et le réducteur le plus fort des 2 couples.
par exemple ,si Ox2 plus fort que Ox1 ,alors red 1 plus fort que red 2
La réaction naturelle sera
Ox2 +red 1 = Ox1 + red 2
Pour obtenir cette équation ,il est logique d'additionner les 1/2 équations
(Ox2 +ne- = red2 )*k
et
(Red1 = ox1 + n'e )*k'
k et k' étant choisis de façon à ce que k*ne- k'*n'e-
Bonsoir, merci pour votre réponse coriolan.
Je ne comprends pas trop la 2ème partie de votre réponse, comment sait-on si un oxydant est plus fort qu'un autre ? Mon professeur ne nous en a pas parlé.
Et donc ce que vous m'avez dit s'applique pour toutes les équations d'oxydoréduction ?
Je ne vous cache pas que je suis un petit peu perdu 
bonjour
e ne comprends pas trop la 2ème partie de votre réponse, comment sait-on si un oxydant est plus fort qu'un autre ? Mon professeur ne nous en a pas parlé.
je pense que cela ne va pas tarder!
Néanmoins ,voici un exemple
quand on plonge une lame de fer dans une solution de Cu2+,on observe un dépôt de Cu ,une décoloration de la solution
les couples rédox en jeu sont Cu2+/Cu et Fe+2/Fe
les oxydants de chaque couple sont Cu2+ et Fe2+
les réducteurs de chaque couple sont Cu et Fe.
On explique la réaction qui se produit de la manière suivante:
Cu2+ est réduit en Cu selon la 1/2 équation
Cu2+ + 2e = Cu
le fer est oxydé selon la 1/2 équation
Fe = Fe2+ + 2e
globalement ,on a
Cu2+ +Fe = Cu + Fe2+
Si on répète l'expérience avec une lame de Cu trempée dans une solution de Fe2+, rien ne se produit.
on déduit de ces expériences que Cu2+ est un oxydant plus fort que Fe2+ et que Fe est un réducteur plus fort que Cu.
on peut classer les oxydants (et les réducteurs) ,les uns par rapport aux autres.On trouve des tableaux de classement des couples redox
exemple [
un exemple de tableau redox.
L'oxydant le plus fort est en haut (Au3+),le réducteur le plus fort est en bas (K)
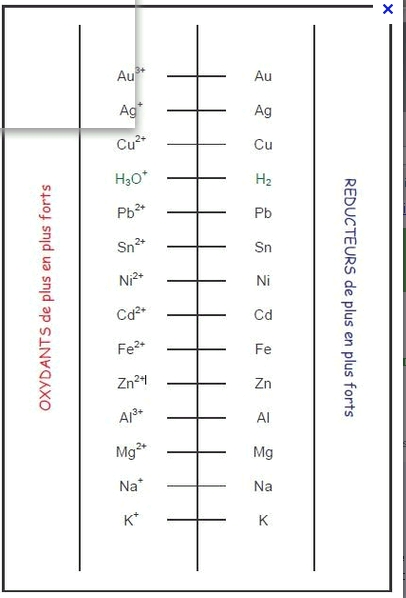
bonjour
Avec cette exemple je comprends mais si l'on me donne un exercice qu'avec 2 couples et que je dois écrire l'équation d'oxydoréduction, comment peut-on deviner quel oxydant est le plus fort ?
Je dois donc apprendre le tableau de classement de couples redox ?
merci 


