Inscription / Connexion Nouveau Sujet
Avancement d'une reaction chimique
Bonjour je ne comprend pas un exo et je voudrais avoir un peu d'aide car celui ci est noté 
Voici l'ennoncé :
On realise le broyage d'un mortier, de 1,0g de nitrate de plomb, Pb(NO3)2, avec 1,0g d'iodure de potassium KI.
a)Quelle équation chimique traduit cette transformation?
b)Déterminer les masses molaire des reactifs?
c)Etablir un tableau d'avancement pour cette reaction chimique.
d)En deduire le reactif limitant de cette reaction chimique.
e)Calculer la masse de chaque produit formé.
f)On recomence l'experience en remplacant l'iodure de potassiim pas de l'iodure de sodium NaI.
On utilise toujours 1g de chaque reactif.Répondre à nouveau aux questions a), b), et e).Pourquoi le changement de reactif est-il a l'origine d'une telle modification dans le bilan?
Malgrés que je n'est pas compri j'ai essayer d'en faire quelque une  :
:
a)Equation chimique: Pb(NO3)2 + 2KI ---->PbI2 +2KNO3
b)reactif: Pb=207,2
N=14,0
O=16,0
K=39,1
I=126,9
207,2+28,0+96+78,2+253,8=663,2
La masse molaire des reactifs est 663,2g.mol-1
c) Je sait vraiment pas comment le faire 
d)Je pense que le reactif limitant est Pb
e) Pb=207,2g.mol-1
N=14,0g.mol-1
O=16,0g.mol-1
K=39,1g.mol-1
I=126,9g.mol-1
f)On verra aprer toute les questions 
Bonjour,
1. Ok
2. Il faut calculer la masse molaire
pour le premier et pour le deuxième réactif, pas sommer les deux !
3. Relire ceci : ![]()
4. A l'état maximal, tous les réactifs ont réagi, leur quantité de matière est nulle :
on choisit le plus petit des xmax, donnant par la même occasion le réactif limitant.
salut merci de m'aider 
donc b) 207,2+(14,0+16 3)2=387,2
3)2=387,2
La masse molaire du premier reactifs est 387,2g.mol-1
2(39,1+126,9)=332
La masse molaire du deusieme reactifs est 387,2g.mol-1
c)
oups beug je continue...
c) Reactifs Produits
Avancement Pb(NO3)2 + 2KI PbI2 +2KNO3
etat initial x=0 0 0
en cours de x 0
0
transfomation
etat final xmax'
c'est tout se que j'ai compris :s
Tu peux calculer les quantités de matière initiales de chaque réactif.
(tu as les masses et les masse molaires).
Je relis tes masses molaires et elles sont fausses !
M(KI) = M(K) + M(I) = 39,1 + 126,9 = ....... g/mol
décomposer de la même façon pour l'autre. Pour ce calcul, il ne faut pas faire intervenir les coefficients stoechiométriques de l'équation !
b)M(KI)=39,1+126,9=166 g/mol
M(Pb(NO3)2)=1M(Pb)+2M(N)+6M(O)=207,2+2*14+6*16=371,2g/mol
c)Se tableau je n'y arrive pas alors que l'autre jlavais fait tu peut pas m'indiquer quelque case pour que j'avance stp(et comment faire un tableau dans un topic si ta le temps  )
)
d) Il me faut le tableau ?? car le reactif limitant c le plus ptit nombre des xmax si j'ai bien compris
b. Ok
c. Je t'ai donné un lien je te rappelle.
d. Il faut utiliser le tableau.
Malheureusement, je ne sais pas faire de tableau avec le Latex ...
Tu peux en faire un avec paint pas exemple.
Reactif produit
etats initial x=0 n Pb(NO3)2 + 2KI 0 + 0
en cours x n Pb(NO3)2-x + 2KI-x PbI2+x + 2KNO3+x
etats final xmas n Pb(NO3)2-xmax + 2KI-xmax PbI2+xmax + 2KNO3+xmax
C'est tout se que je suis arriver a faire ... jpense que la colonne des produits et fausse tu peut me donner ton avis??
A l'état initial, tu peux calculer les quantités de matières des réactifs :
ni(Pb(NO3)2) = m(Pb(NO3)2) / M(Pb(NO3)2) = 1,0 / 371,2 = 0,0027 mol
ni(KI) = m(KI) / M(KI) = 1,0 / 166 = 0,0060 mol.
Voici un tableau d'avancement,
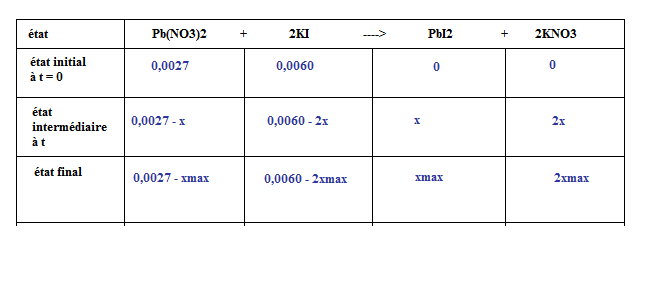
A l'état maximal, tous les réactifs ont réagi leurs quantités de matière sont nulles. D'après le tableau d'avancement,
0,0027 - xmax = 0 <=> xmax = 0,0027 mol
0,0060 - 2xmax = 0 <=> xmax = 0,0030 mol
on choisit le plus petit des xmax donc x max = 0,0027 mol et Pb(NO3)2 est le réactif limitant.
Donc nf(PbI2) = xmax = 0,0027 mol
la masse molaire de PbI2 est M(PbI2) = M(Pb) + 2M(I) = 461 g/mol
soit m(PbI2) = nf(PbI2).M(PbI2) = 0,0027*461 = 1,25 g de PbI2 formé.
Seule chose, ton équation-bilan me dérange un peu. Elle a été donnée par l'énoncé ?
Et mince !
Ta masse molaire est fausse !
M(Pb(NO3)2)=1M(Pb)+2M(N)+6M(O)=207,2+2*14+6*16=371,2g/mol c'est 331,2 g/mol
Il faut donc refaire toutes les applications numériques et refaire les calculs à l'état maximal car le réactif limitant ne sera plus le même ...
Pour que les autres membres puissent trouver une solution claire et ordonnée :
On réalise le broyage d'un mortier, de 1,0g de nitrate de plomb, Pb(NO3)2, avec 1,0g d'iodure de potassium KI.
1. Enoncé de l'exercice
a)Quelle équation chimique traduit cette transformation?
b)Déterminer les masses molaire des reactifs?
c)Etablir un tableau d'avancement pour cette reaction chimique.
d)En deduire le réactif limitant de cette reaction chimique.
e)Calculer la masse de chaque produit formé.
f)On recommence l'expérience en remplacant l'iodure de potassium pas de l'iodure de sodium NaI.
On utilise toujours 1g de chaque réactif. Répondre à nouveau aux questions a), b), et e).Pourquoi le changement de réactif est-il a l'origine d'une telle modification dans le bilan?
2. Solution de l'exercice
a. L'équation de la réaction est Pb(NO3)2 + 2KI ----> PbI2 +2KNO3
Remarque : normalement, les ions qui réagissent sont I- et Pb2+ (K+ et NO3- étant des ions spectateurs) selon l'équation Pb2+ + 2I- ---> PbI2. Etant donné que la réaction ne se fait pas en solution aqueuse, je prefère laisser la première équation-bilan (avec des espèces solides).
b. Calculons les masses molaires des réactifs :
M(KI) = M(K) + M(I) = 166 g/mol
M(Pb(NO3)2) = M(Pb) + 2M(N) + 6M(O) = 331,2 g/mol
c.
Calculons d'abord les quantités de matières initiales des réactifs (à t=0) :
ni(KI) = m/M(KI) = 1,0 / 166 = 0,00602 mol
ni(Pb(NO3)2) = m/M(Pb(NO3)2) = 1,0 / 331,2 = 0,00302 mol
On remplit le tableau d'avancement suivant (de la même façon que le tableau précédent en remplaçant cette fois-ci par les bonnes valeurs numériques) :
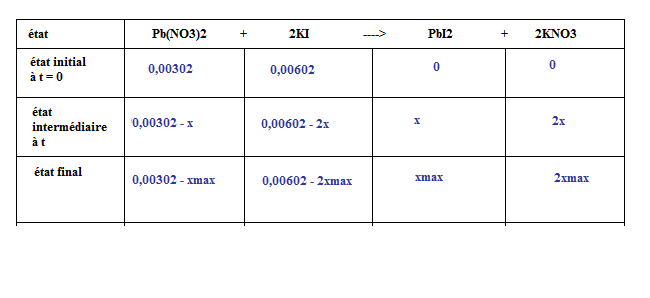
d. A l'état maximal, tous les réactifs ont réagi, leurs quantités de matière sont nulles :
0,00302 - xmax = 0 <=> xmax = 0,00302 mol
0,00602 - 2xmax = 0 <=> xmax = 0,00301 mol
on choisit le plus petit des xmax donc xmax = 0,00301 mol --> KI est le réactif limitant
Donc, à l'état final, nf(PbI2) = xmax = 0,00301 mol.
e.On peut déterminer la masse de PbI2 apparue par m(PbI2) = nf(PI2).M(PbI2)
avec M(PbI2) = M(Pb) + 2M(I) = 461 g/mol
donc m(PbI2) = 0,00301*461 = 1,39 g de PbI2 formé.
f. Même méthode sauf qu'il faut
* calculer la masse molaire de NaI : M(NaI) = M(Na) + M(I) = 150 g/mol
* calculer la quantité de matière initiale en NaI
* déterminer la masse de PbI2 formée.

Merci pour tout se que tu a fait t'est trop simpa je suis en train de lire tout se que ta mis 
et j'espere que jcomprend
Erf , tu m'a dit que ma masse molaire étaient fausse Mais moi j'ai prit les masse molaire de mon livre donc tu peut me detailler le calcul pour M(Pb(NO3)2) s'il te plaît
a ouais ok enfaite j'ai crut taver citer mon calcul est qui y avait une masse molaire de fausse et que t'avait corriger que le resultat RALALA!! comment j'ai put croire sa de toi ... 
Ouais ba y en a qui me repondent plus je croit qui sont "dead" enfin j'espere pas 
mais bon vous etes trop simpa d'aider les gens en difficulté c cool
Quand l'élève en face fait des efforts et tente de donner des pistes de réflexion, on aime bien aider 
Malheureusement, c'est rarement le cas et il arrive souvent qu'un correcteur dise "Que proposes-tu ?" ou encore "Qu'as-tu cherché ?", car les premières questions sont souvent des questions de cours.
C'est de cette façon qu'on progresse.
Bonne soirée 
Moi ta pas eut besoin de dire "Qu'as-tu cherché ?" car je te l'ait dit direct hein !  mais c'est parfaitement normal de dire se qu'on a trouver car sinon ont veut juste avoir les reponses sans avoir compris ... J'appel sa de la mauvaise volonté.
mais c'est parfaitement normal de dire se qu'on a trouver car sinon ont veut juste avoir les reponses sans avoir compris ... J'appel sa de la mauvaise volonté.
Quand j'aurais finit la "d)" jpourrais te l'envoyer pour voir si c bon ?? 
heuuu ... jveut dire la "f)" !! et elle me pose deja probleme pour l'equation
Pb(NO3)2 + NaI ------> ???
sinon j'ai finit la e)
M(KNO3)=39,1+14+3*16=101,1
La masse molaire du pproduit KNO3 est 101,1g/mol mais ayant le nombre stoechiometrique "2" sa masse molaire est 202,2g.mol
m(2KNO3)=3,01.10-3 202,2=0,609g
202,2=0,609g
Il y a donc eut 0,609g de KNO3 produit
Voila jpense que j'ai juste mais bon j'attend l'avis du chef 
C'est la même chose que précédemment.
Encore une fois, les réactifs sont les ions Pb2+ et I- tels que Pb2+ + 2I- ---> PbI2.
Mais puisqu'ici la réaction se passent entre des espèces solides, je préfère écrire :
Pb(NO3)2 + 2NaI ----> PbI2 +2NaNO3
(surtout, marque ce commentaire sur ta copie car ton prof pourrait dire que cette équation est fausse).
Attention, ne confond pas masse molaire et quantité de matière.
Pour cette question, c'est exactement la même chose :
* L'équation de la réaction est Pb(NO3)2 + 2NaI ----> PbI2 +2NaNO3
Remarque : normalement, les ions qui réagissent sont I- et Pb2+ (Na+ et NO3- étant des ions spectateurs) selon l'équation Pb2+ + 2I- ---> PbI2. Etant donné que la réaction ne se fait pas en solution aqueuse, je prefère laisser la première équation-bilan (avec des espèces solides).
* Calculons les masses molaires des réactifs :
M(NaI) = M(Na) + M(I) = 150 g/mol
M(Pb(NO3)2) = M(Pb) + 2M(N) + 6M(O) = 331,2 g/mol
* Calculons d'abord les quantités de matières initiales des réactifs (à t=0) :
ni(NaI) = m/M(NaI) = 1,0 / 150 = 0,00667 mol
ni(Pb(NO3)2) = m/M(Pb(NO3)2) = 1,0 / 331,2 = 0,00302 mol
On remplit le tableau d'avancement suivant (je te laisse le faire)
* A l'état maximal, tous les réactifs ont réagi, leurs quantités de matière sont nulles :
0,00302 - xmax = 0 <=> xmax = 0,00302 mol
0,00667 - 2xmax = 0 <=> xmax = 0,00334 mol
on choisit le plus petit des xmax donc xmax = 0,00302 mol --> cette fois-ci, Pb(NO3)2 est le réactif limitant
Donc, à l'état final, nf(PbI2) = xmax = 0,00302 mol.
* On peut déterminer la masse de PbI2 apparue par m(PbI2) = nf(PI2).M(PbI2)
avec M(PbI2) = M(Pb) + 2M(I) = 461 g/mol
donc m(PbI2) = 0,00302*461 = 1,392 g de PbI2 formé.
Je viens de m'apercevoir qu'il faut dans la question e. laisser 4 chiffres significatifs donc m(PbI2) = 1,388 g (à modifier dans mon message posté 22-04-10 à 11:07)
On remarque que la réaction entre Pb(NO3)2 avec KI d'une part, et NaI d'autre part ne donnent pas les mêmes réctifs limitants. Cela est dû à la masse molaire des deux espèces KI et NaI

T le meilleur! franchement tu gere trop c trop simpa d'aider les gens comme ca et franchement c trop un avantage que ce n'est pas payant parce que franchement vous nous donner lgout de travailler parce que perso sa sré payant je preferais avoir des mauvaise note que payé  , bref RESPECT!
, bref RESPECT!











Je t'en prie.
Quelques conseils que je peux te donner :
* revoir les notions liées aux quantités de matière, masse molaire, etc ...
* savoir remplir un tableau d'avancement de
- déterminer les quantités de matière initiales des réactifs
- déterminer l'avancement maximal (le plus petit des xmax) et donc le réactif limitant
- déterminer les quantités de matière des espèces formées (produits).
Je te conseille d'imprimer cet exercice car je t'ai donné un modèle de rédaction, des méthodes, etc ...
Bon courage et à bientôt 


