Inscription / Connexion Nouveau Sujet
Représentation de Lewis & doublets non liants
Bonjour ,
J'arrive assez bien à faire les représentations de Lewis seulement je ne sais jamais quand il faut mettre des doublets non liants ou pas .
Pouvez -vous donc m'indiquer comment savoir s'il faut mettre des doublets non liants mais surtout combien ? merci !
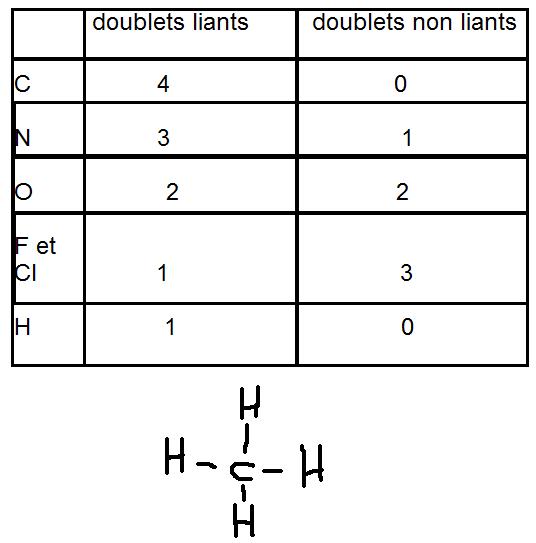
Bonjour, je t'ai fait un tableau que je trouve bien utile avec les atomes C, O etc, enfin les plus connus.
Comme tu le vois,la représentation de Lewis de la moléculs CH4 correspond bien au tableau, chaque H est entouré d'un doublet liant et 0 non liant et C est entouré de 4 doublets liants et 0 non liant.
Je ne sais pas si je réponds à ta question..
Bonsoir,
Il faut que tu écrives la configuration électronique de l'atome avec le remplissage des couches (K), (L) et (M).
Prenons deux exemples :
(a) L'atome de carbone : Z=6 d'où la configuration électronique suivante (K)2(L)4. Tous les atomes tendent à obtenir la configuration la plus stable possible, c'est-à-dire en duet ou en octet.
Ici, il faut gagner quatre électrons pour avoir une structure en octet. En effet, la couche (L) peut contenir jusqu'à huit électrons, il en faut donc quatre de plus pour qu'elle soit entièrement remplie.
Le carbone engage donc quatre liaisons, ce sont les doublets liants.
Pour calculer le nombre de doublets non-liants, il faut calculer la différence entre le nombre d'électrons sur la couche externe et le nombre d'électrons engagés dans un doublet liant. Ici, on a 4-4=0 donc aucun doublet non liant.
(b) L'atome d'oxygène : Z=16 d'où la configuration électronique suivante (K)2(L)8(M)6.
Pour obtenir une structure en octet, il faut que l'oxygène gagne deux électrons pour saturer la couche (M). Il engage donc une seule double liaison.
Il reste donc 6-4=2 électrons sur sa couche externe, d'où un seul doublet liant.
Et voilà 
Pour voir si tu as bien compris la méthode, essaye avec de l'appliquer sur l'exemple de l'azote (Z=7) et je te dirais si c'est correct.



